Ковалентная неполярная химическая связь осуществляется в молекуле. Ковалентная химическая связь
Впервые о таком понятии как ковалентная связь ученые-химики заговорили после открытия Гилберта Ньютона Льюиса, который описал как обобществление двух электронов. Более поздние исследования позволили описать и сам принцип ковалентной связи. Слово ковалентный можно рассматривать в рамках химии как способность атома образовывать связи с другими атомами.
Поясним на примере:
Имеется два атома с незначительными отличиями в электроотрицательности (С и CL, С и Н). Как правило, это которых максимально близко к строению электронной оболочки благородных газов.
При выполнении данных условий возникает притяжение ядер этих атомов к электронной паре, общей для них. При этом электронные облака не просто накладываются друг на друга, как при Ковалентная связь обеспечивает надежное соединение двух атомов за счет того, что перераспределяется электронная плотность и изменяется энергия системы, что вызвано "втягиванием" в межъядерное пространство одного атома электронного облака другого. Чем более обширно взаимное перекрытие электронных облаков, тем связь считается более прочной.
Отсюда, ковалентная связь - это образование, возникшее путем взаимного обобществления двух электронов, принадлежащих двум атомам.
Как правило, вещества с молекулярной кристаллической решеткой образуются посредством именно ковалентной связи. Характерными для являются плавление и кипение при низких температурах, плохая растворимость в воде и низкая электропроводность. Отсюда можно сделать вывод: в основе строения таких элементов, как германий, кремний, хлор, водород - ковалентная связь.
Свойства, характерные для данного вида соединения:
- Насыщаемость. Под этим свойством обычно понимается максимальное количество связей, которое они могут установить конкретные атомы. Определяется это количество общим числом тех орбиталей в атоме, которые могут участвовать в образовании химических связей. Валентность атома, с другой стороны, может быть определена числом уже использованных с этой целью орбиталей.
- Направленность . Все атомы стремятся образовывать максимально прочные связи. Наибольшая прочность достигается в случае совпадения пространственной направленности электронных облаков двух атомов, поскольку они перекрывают друг друга. Кроме того, именно такое свойство ковалентной связи как направленность влияет на пространственное расположение молекул то есть отвечает за их "геометрическую форму".
- Поляризуемость. В основе этого положения лежит представление о том, что ковалентная связь существует двух видов:
- полярная или несимметричная. Связь данного вида могут образовывать только атомы разны видов, т.е. те, чья электроотрицательность значительно различается, либо в случаях, когда общая электронная пара несимметрично разделена.
- возникает между атомами, электроотрицательность которых практически равна, а распределение электронной плотности равномерно.
Кроме того, существуют определенные количественные :
- Энергия связи . Данный параметр характеризует полярную связь с точки зрения ее прочности. Под энергией понимается то количество тепла, которое было необходимо для разрушения связи двух атомов, а также то количество тепла, что было выделено при их соединении.
- Под длиной связ и в молекулярной химии понимается длина прямой между ядрами двух атомов. Этот параметр также характеризует прочность связи.
- Дипольный момент - величина, которая характеризует полярность валентной связи.
Ковалентная, ионная и металлическая – три основных типа химических связей.
Познакомимся подробнее с ковалентной химической связью . Рассмотрим механизм ее возникновения. В качестве примера возьмем образование молекулы водорода:
Сферически симметричное облако, образованное 1s-электроном, окружает ядро свободного атома водорода. Когда атомы сближаются до определенного расстояния, происходит частичное перекрывание их орбиталей (см. рис.), в результате чего появляется молекулярное двухэлектронное облако между центрами обоих ядер, которое обладает максимальной электронной плотностью в пространстве между ядрами. При увеличении же плотности отрицательного заряда происходит сильное возрастание сил притяжения между молекулярным облаком и ядрами.
в результате чего появляется молекулярное двухэлектронное облако между центрами обоих ядер, которое обладает максимальной электронной плотностью в пространстве между ядрами. При увеличении же плотности отрицательного заряда происходит сильное возрастание сил притяжения между молекулярным облаком и ядрами.
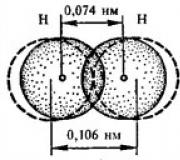
Итак, мы видим, что ковалентная связь образуется путем перекрывания электронных облаков атомов, которое сопровождается выделением энергии. Если расстояние между ядрами у сблизившихся до касания атомов составляет 0,106 нм, тогда после перекрывания электронных облаков оно составит 0,074 нм. Чем больше перекрывание электронных орбиталей, тем прочнее химическая связь.
Ковалентной называется химическая связь, осуществляемая электронными парами . Соединения с ковалентной связью называют гомеополярными или атомными .
Существуют две разновидности ковалентной связи : полярная и неполярная .
При неполярной ковалентной связи образованное общей парой электронов электронное облако распределяется симметрично относительно ядер обоих атомов. В качестве примера могут выступать двухатомне молекулы, которые состоят из одного элемента: Cl 2 , N 2 , H 2 , F 2 , O 2 и другие, электронная пара в которых в принадлежит обоим атомам в одинаковой мере.
При полярной ковалентной связи электронное облако смещено к атому с большей относительной электроотрицательностью. Например молекулы летучих неорганических соединений таких как H 2 S, HCl, H 2 O и другие.
Образование молекулы HCl можно представить в следущем виде:
![]()
Т.к. относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1), электронная пара смещается к атому хлора.
Помимо обменного механизма образования ковалентной связи – за счет перекрывания, также существует донорно-акцепторный механизм ее образования. Это механизм, при котором образование ковалентной связи происходит за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора). Давайте рассмотрим пример механизма образования аммония NH 4 + .В молекуле аммиака у атома азота есть двухэлектронное облако:
Ион водорода имеет свободную 1s-орбиталь, обозначим это как .
В процессе образования иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, это значит оно преобразуется в молекулярное электронное облако. Следовательно, появляется четвертая ковалентная связь. Можно представить процесс образования аммония такой схемой:
Заряд иона водорода рассредоточен между всеми атомами, а двухэлектронное облако, которое принадлежит азоту, становится общим с водородом.
Остались вопросы? Не знаете, как сделать домашнее задание?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Химическим элементарным частицам свойственно соединяться друг с другом посредством формирования специальных взаимосвязей. Они бывают полярными и неполярными. Каждая из них имеет определенный механизм формирования и условия возникновения.
Вконтакте
Что это
Ковалентная связь — это образование, возникающее у элементов с неметаллическими свойствами . Наличие приставки «ко» свидетельствует о совместном участии атомных электронов разных элементов.
Понятие «валенты» означает наличие определенной силы. Возникновение такой взаимосвязи происходит посредством обобществления атомных электронов, не имеющих «пары».
Указанные химические связи возникают за счет появления «копилки» электронов, являющейся общей для обеих взаимодействующих частиц. Появление пар электронов осуществляется вследствие накладывания друг на друга электронных орбиталей. Указанные виды взаимодействия возникают между электронными облаками обоих элементов .
Важно! Ковалентная взаимосвязь появляется в случае объединения пары орбиталей.
Веществами с описанной структурой являются:
- многочисленные газы;
- спирты;
- углеводы;
- белки;
- органические кислоты.
Ковалентная химическая связь образуется за счет формирования общественных пар электронов у простых веществ либо сложных соединений. Она бывает полярная и неполярная.
 Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц
, присутствующих в формуле.
Как определить природу химической связи? Для этого необходимо посмотреть на атомную составляющую частиц
, присутствующих в формуле.
Химические связи описанного вида формируются только между элементами, где преобладают неметаллические свойства.
Если в соединении присутствуют атомы одинаковых либо разных неметаллов, значит возникающие между ними взаимосвязи – «ковалентные».
Когда в соединении одновременно присутствуют металл и неметалл говорят об образовании взаимосвязи.
Структура с «полюсами»
Ковалентная полярная связь соединяет друг с другом атомы разных по природе неметаллов. Это могут быть атомы:
- фосфора и ;
- хлора и ;
- аммиака.
Есть и другое определение для указанных веществ. Оно говорит о том, что данная «цепочка» формируется между неметаллами с разными показателями электроотрицательности. В обоих случаях «подчеркивается» разновидность химических элементов-атомов, где возникла эта взаимосвязь.
Формула вещества с ковалентной полярной связью – это:
- NO и многие другие.
Представленные соединения в нормальных условиях могут иметь жидкие либо газообразные агрегатные состояния. Формула Льюиса помогает точнее понять механизм связывания атомных ядер.
Как появляется
 Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Механизм образования ковалентной связи для атомных частиц с разными значениями электроотрицательности сводится к формированию общей плотности электронной природы.
Обычно она смещается к элементу, имеющему наибольший показатель электроотрицательности. Его можно определить по специальной таблице.
Из-за смещения общей пары «электрончиков» в сторону элемента с большим значением электроотрицательности, на нем частично формируется отрицательный заряд.
Соответственно другой элемент получит частичный положительный заряд. Вследствие этого образуется соединение с двумя разнозаряженными полюсами.
Нередко при образовании полярной взаимосвязи используется акцепторный механизм или донорно-акцепторный механизм. Примером вещества, образованного по данному механизму, служит молекула аммиака. В нем азот наделен свободной орбиталью, а водород – свободным электроном. Образующая общая электронная пара занимает данную орбиталь азота, в результате чего один элемент становится донором, а другой акцептором.
Описанный механизм образования ковалентной связи , как вид взаимодействия, характерен не для всех соединений с полярным связыванием. Примерами могут служить вещества органического, а также неорганического происхождения.
О неполярной структуре
Ковалентная неполярная связь связывает между собой элементы с неметаллическими свойствами, имеющими одинаковые значения электроотрицательности. Другими словами, вещества с ковалентной неполярной связью — это соединения, состоящие из разного количества идентичных неметаллов.
Формула вещества с ковалентной неполярной взаимосвязью:
 Примеры соединений, относящиеся к указанной категории являются веществами простого строения
. В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
Примеры соединений, относящиеся к указанной категории являются веществами простого строения
. В формировании этого типа взаимодействия, как и других неметаллических взаимосвязей, задействуются «крайние» электроны.
В некоторой литературе их именуют валентными. Под подразумевают количество электронов, необходимых для завершения внешней оболочки. Атом может отдавать или принимать отрицательно заряженные частицы.
Описанная взаимосвязь относится к категории двухэлектронных либо двухцентровых цепочек. При этом пара электронов занимает общее положение между двумя орбиталями элементов. В структурных формулах электронную пару записывают в виде горизонтальной черты или «-». Каждая такая черточка показывает количество общих электронных пар в молекуле.
Для разрыва веществ с указанным видом взаимосвязи требуется затратить максимальное количество энергии, поэтому эти вещества являются одними из прочных по шкале прочности.
Внимание! В данную категорию относят алмаз – одно из самых прочных соединений в природе.
Как появляется
По донорно-акцепторному механизму неполярные взаимосвязи практически не соединяются. Ковалентная неполярная связь — это структура, формирующаяся посредством возникновения общих пар электронов. Данные пары в одинаковой степени принадлежат обоих атомам. Кратное связывание по формуле Льюиса точнее дает представление о механизме соединения атомов в молекуле.
Сходством ковалентной полярной и неполярной связи является появление общей электронной плотности. Только во втором случае образующиеся электронные «копилки» в одинаковой мере принадлежат обоим атомам, занимая центральное положение. В результате не образуются частичные положительные и отрицательные заряды, а значит образующиеся «цепи» являются неполярными.
Важно! Неполярная взаимосвязь приводит к образованию общей электронной пары, за счет чего последний электронный уровень атома становится завершенным.
Свойства веществ с описанными структурами существенно различаются от свойств веществ с металлической либо ионной взаимосвязью.
Что такое ковалентная полярная связь
Какие бывают виды химической связи
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь .
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY) < E(X) + E(Y)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
В образовании химических связей принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными . Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s- орбитали и 1 на 2p -орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl 4 , H 2 S, CO 2 , NH 3 , SiO 2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH 4 + :
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом , а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом .
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:

Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F − , Cl − , S 2-), а также между простыми катионами и сложными анионами (NO 3 − , SO 4 2- , PO 4 3- , OH −). Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH)
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М 0 — ne − = M n + ,
где М 0 – нейтральный атом металла, а M n + катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Ковалентная химическая связь возникает между атомами с близкими или равными значениями электроотрицательностей. Предположим, что хлор и водород стремятся отнять электроны и принять структуру ближайшего благородного газа, значит ни один из них не отдаст электрон другому. Каким же способом они все таки соединяются? Все просто – они поделятся друг с другом, образуется общая электронная пара.

Теперь рассмотрим отличительные черты ковалентной связи.
В отличие от ионных соединений, молекулы ковалентных соединений удерживаются вместе за счет «межмолекулярных сил», которые намного слабее химических связей. В связи с этим, ковалентной связи характерна насыщаемость – образование ограниченного числа связей.
Известно, что атомные орбитали ориентированы в пространстве определенным образом, поэтому при образовании связи, перекрывание электронных облаков происходит в определенном направлении. Т.е. реализуется такое свойство ковалентной связи как направленность.
Если ковалентная связь в молекуле образована одинаковыми атомами или атомами с равной электроотрицательностью, то такая связь не имеет полярности, т.е электронная плотность распределяется симметрично. Называется она неполярной ковалентной связью (H 2 , Cl 2 , O 2 ). Связи могут быть как одинарными, так и двойными, тройными.
Если электроотрицательности атомов различаются, то при их соединении электронная плотность распределяется между атомами неравномерно и образуется ковалентная полярная связь (HCl, H 2 O, CO), кратность которой также может быть различной. При образовании данного типа связи, более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд (δ- и δ+). Образуется электрический диполь, в котором заряды, противоположные по знаку, расположены на неком расстоянии друг от друга. В качестве меры полярности связи используют дипольный момент:

Полярность соединения тем более выражена, чем больше дипольный момент. Молекулы будут иметь неполярный характер, если дипольный момент равен нулю.
В связи с вышеперечисленными особенностями, можно заключить, что ковалентные соединения летучи, имеют низкие температуры плавления и кипения. Электрический ток не может проходить через эти соединения, следовательно, они плохие проводники и хорошие изоляторы. При подводе тепла, многие соединения с ковалентной связью, загораются. В большей части это углеводороды, а также оксиды, сульфиды, галогениды неметаллов и переходных металлов.
Категории ,