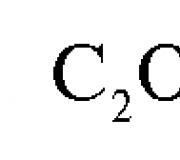Методы определения ионов кальция. Скачать книгу "Аналитическая химия кальция" (2.28Mb) Определение содержания кальция в гипсе методом титрования
Методы количественного определения кальция. Существуют различные методы определения кальция.
Гравиметрические методы.
1. Осаждение в виде оксалата СаС 2 О 4 -Н 2 О и взвешивание в виде СаСО 3 или СаО (см. «Гравиметрический анализ»).
2. Осаждение в виде сульфата CaSO 4 из спиртового раствора.
3. Осаждение в виде пикролоната Ca(C 10 H 7 O 5 N 4) 2 8H 2 O.
Титриметрические методы.
1. Осаждение в виде оксалата кальция и последующее определение связанного с кальцием оксалат-иона методом перманганатометрии или цериметрии.
2. Осаждение в виде молибдата СаМоО 4 , восстановление молибдена и титрование его ванадатом аммония.
3. Комплексонометрический метод.
Гравиметрический метод определения кальция имеет весьма существенные недостатки.
1. Определение содержания кальция в различных технических объектах гравиметрическим методом представляет собой весьма длительную операцию.
2. Осаждение ионов кальция в виде СаС 2 О 4 связано с большими трудностями, обусловливаемыми невозможностью достижения количественного выделения оксалата кальция;
3. Осадок оксалата кальция бывает часто загрязнен посторонними примесями, и его трудно выделить в химически чистом виде.
4. Получение весовой формы (СаО) связано с применением относительно высокой температуры, необходимой для термического разложения оксалата кальция.
5. Получаемая весовая форма (СаО) нестабильна и подвергается действию влаги и двуокиси углерода воздуха, вследствие чего ее масса меняется в зависимости от условий получения и хранения.
Поэтому в настоящее время гравиметрический метод определения кальция утратил прежнее свое значение и вытеснен более прогрессивными титриметрическими методами анализа.
Перманганатометрический метод определения кальция отличается рядом преимуществ по сравнению с гравиметрическим методом анализа. Одним из таких преимуществ является более быстрое завершение операции определения. Однако перманганатометрическому методу определения кальция, основанному на осаждении ионов кальция в виде оксалата и последующем титровании оксалат-ионов перманганатом, свойственны многие недостатки анализа, связанные с невозможностью полного количественного осаждения и отделения оксалата кальция.
Из титриметрических методов анализа наиболее точным и быстрым методом определения кальция, несомненно, является комплексонометрическое титрование ионов кальция ЭДТА.
Комплексонометрический метод определения кальция. Комплексо-нометрическое определение кальция, основано на прямом методе титрования его ионов стандартным раствором ЭДТА в присутствии мурексида или кислотного хром темно-синего. Индикатор образует с ионами кальция комплексное соединение красного цвета. При титровании раствора ЭДТА в точке эквивалентности красная окраска переходит в окраску, характерную для свободного индикатора.
В результате титрования солей кальция ЭДТА происходит образование комплекса CaY 2 ‑ и кислоты:
Са 2+ + H 2 Y 2 ‑ ⇄CaY 2 ‑ + 2Н +
Образующийся комплекс CaY 2 ‑ относительно неустойчив:
╱ =310 ‑11
Образование свободной кислоты во время реакции или прибавление ее в титруемый раствор перед титрованием сдвигает указанное равновесие влево, т. е. в сторону разрушения комплекса.
ЭДТУ является четырехосновной кислотой, характеризуется следующими константами: pK 1 = 2; рК 2 = 2,7; рК 3 = 6,2; рК 4 = 10,3и представляет собой относительно слабую кислоту, поэтому рН раствора ее комплекса с Са 2+ не должен быть ниже 10,3. Если рН будет меньше, то Y 4 ‑ с Н + образует соответствующие гидроанионы: HY 3 ‑ , H 2 Y 2 ‑ , H 3 Y ‑ и кислоту H 4 Y. При этом комплекс CaY 2 ‑ разрушается или не образуется совсем.
Таким образом, устойчивость внутрикомплексной соли, образуемой ионами кальция с ЭДТА, зависит от рН раствора. Для обеспечения оптимального течения реакции образования комплекса CaY 2 ‑ титрование солей кальция раствором ЭДТА нужно проводить в сильнощелочной среде при рН > 12. В этом случае достигается полная нейтрализация образующейся в процессе титрования свободной кислоты и наблюдается максимальный скачок кривой титрования.
ь уменьшается с увеличением концентрации кальция) . Повышение рН приводит к уменьшению чувствительности (рис. 21). Оптимальное количество щелочи - 5мл 10%-ного раствора NaOH/ЮО. При фотометрическом определении кальция используют 0,02%-ный водный раствор кислотного хром темно-синего . Водные растворы реагента устойчивы несколько недель . Определению
мешают Al, Fe, Co, Ni, Mn . Влияние этих элементов устраняют маскированием триэтаноламином с добавлением фторида натрия , либо 1%-ного раствора цианида натрия .
Фотометрический метод определения кальция с кислотным хром темно-синим применяется при анализе цементных сырьевых смесей и клинкеров . Метод предложен для определения больших количеств кальция (40 -45% СаО). При этом большую часть кальция связывают в бесцветный комплекс с комплексоном III, а оставшийся кальций (~6%) определяют по цветной реакции с кислотным хром темно-синим.
0,15 г анализируемого материала сплавляют с 1 ч. смеси (1 г буры и 2 ч. соды), плав растворяют в 100 мл HG1 (1: 3) и разбавляют водой до 500 мл. Из полученного раствора отбирают 20 мл в мерную колбу емкостью 100 мл, добавляют 5 мл раствора, содержащего 1% триэтаноламина и 0,5% NaF, 20 мл 0,00450г7 раствора комплексопа III, нейтрализуют по метиловому красному 1%-ным раствором NaOH и прибавляют избыток 5 мл. Затем добавляют 10 мл 0,02%-ного водпого раствора кислотного хром темно-синего, доводят водой до метки и фотометрируют на ФЭК-М с желтым светофильтром (L = 595 нм) в кювете с I = 1 см.
Кислотный хром темно-синий применен также для фотометрического определения кальция в биологических объектах , чугуне , металлическом титане . Используется также для косвенного фотометрического определения кальция эриохром черный Т .
Определение кальция с другими реагентами]
Кальций осаждают в виде фосфата , молибдата или вольфрамата . Осадок отделяют фильтрованием, растворяют в кислоте и определяют фосфат-ион, молибден, вольфрам соответствующими методами. Для осаждения кальция применяют лоретин, затем фотометрируют лоретинат железа .
В ряде колориметрических методов осаждают кальций в виде K2Ca , а затем определяют N02-ион , никель с диметилглиоксимом , или колори-метрируют зеленую окраску, появляющуюся при взаимодействии K2Ca и нафтилгидроксаматом натрия .
Сульфат Ce(IV) используется для колориметрического олре- -деления кальция после его осаждения оксалатом . Осадок последнего растворяют в серной кислоте, прибавляют избыток Ce(S04)2, измеряют интенсивность окраски. Возможен и следующий вариант косвенного определения кальция: после растворения оксалата кальция в серной кислоте и прибавления избытка Ce(S04)2 и иодида калия фотометрируют по желтой окраске свободного иода или по синей окраске после добавления крахмала .
Кальций может быть определен с высокой точностью фотомет-рированием окраски перманганата калия, прибавленного в избытке к растворенному в кислоте оксалату кальция .
При прибавлении к оксалату кальция хлораниловой кислоты и осаждении хлоранилата кальция определяют последний, измеряя оптическую плотность маточного раствора . Калибровочный график строят для 0-0,2 мг Са.
Один из колориметрических вариантов определения кальция в виде оксалата основан на обесцвечивании оксалатами красной окраски раствора роданида железа . Метод основан на выделении кальция в виде труднорастворимого осадка оксалата СаС204"Н20 (ПР = 2,6-10"9). Известны три гидрата оксалата кальция: СаС204-Н20, СаС204-*2 Н20 и СаС204-ЗН20. При обычных условиях стабильная форма -- моногидрат (получается при осаждении из горячих растворов). Ди- и тригидраты, образующиеся при осаждении в холодном растворе, переходят при стоянии в моногидрат (быстрее -- при нагревании ).
В качестве осадителя часто используют щавелевую кислоту Н2С204 . Некоторые исследователи отдают предпочтение оксалатам натрия и калия . Однако удобнее пользоваться оксалатом аммония , включенным в рациональный ассортимент органических реагентов для осаждения и гравиметрического определения кальция. Для осаждения используют избыток насыщенного раствора оксалата аммония .
При осаждении оксалата кальция применяли метил-, диметил-или диэтилоксалат . В этих случаях образуются более крупные кристаллы.
Оксалат кальция СаС204-Н20 осаждают из кислых и щелочных растворов ; известны методы осаждения из кислых растворов, которые затем нейтрализуют аммиаком до определенного значения рН .
Осаждение оксалата кальция из кислых и щелочных растворов; неэффективно, так как получается мелкозернистый осадок, который трудно отфильтровать и промыть; такой осадок адсорбирует примеси, особенно в присутствии магния . В кислой среде происходит частичное растворение СаС204, в щелочной -- соосаждение Са(ОН)2 и образование СаС03 за счет поглощения аммиаком С02 из воздуха.
Чистые, крупнокристаллические осадки постоянного состава получаются при осаждении СаС204 из кислых растворов с последующей нейтрализацией аммиаком. Чаще всего оксалат кальция осаждают из солянокислой среды . Крупнокристаллические осадки получают и при осаждении оксалата кальция в уксуснокислой среде .
К анализируемому раствору, содержащему кальций, добавляют в присутствии соответствующего индикатора соляную кислоту до кислой реакции, раствор нагревают и приливают избыток горячего насыщенного раствора оксалата аммония. Горячий раствор медленно нейтрализуют аммиаком до перехода окраски индикатора. Благодаря медленной нейтрализации в растворе почти до конца осаждения сохраняется кислая среда, что способствует получению крупных кристаллов с минимальным количеством примесей.
При осаждении оксалата кальция из холодных растворов образуются кристаллические трудно фильтрующиеся осадки . Кипячение способствует переходу в осадок вместе с кальцием и магния, если он присутствует в растворе. Наиболее удобно осаждать оксалат кальция при 60--80° С путем прибавления горячего раствора оксалата аммония к подогретому кислому, раствору, содержащему кальций.
Растворимость оксалата кальция возрастает с увеличением концентрации ионов водорода в растворе, так как присутствие ионов Н50+ приводит к удалению оксалат-ионов из равновесной системы.
Оксалат кальция осаждается количественно при рН 4 [ 272] (практически не ниже 4 и не выше 6) , поэтому индикатором при осаждении СаС204 служит метиловый красный (рН) перехода окраски 4,4-0,2) . Г Обычно пользуются не спиртовым, а водным раствором метилового I красного. Опыты показали, что при осаждении оксалата кальция в присутствии капли спиртового раствора индикатора получаются завышенные результаты на 2% и более . Это связано с тем, что последний захватывается осадком СаСг04, не отмывается итатру-ется перманганатом. Довольно часто используют метиловый оранжевый или бромкрезоловый зеленый .
2.2 Титриметрические методы
Для титриметрического определения кальция наиболее часто используется комплексонометрия.
Комплексонометрическое титрование
С ионами кальция комплексон III образует прочное, растворимое в воде, бесцветное соединение состава 1: 1. Для комплексонв-та кальция рК = 10,96 . Комплексонометрическое титрование кальция проводят в щелочной среде. При рН 10 определяют сумму кальция и магния, при рН 12,5 -- кальций в присутствии магния.
Приводятся обзоры комплексонометрических методов определения кальция и магния и индикаторов, применяемых для этих целей .
Шварценбах и Бидерман предложили определять сумму кальция и магния комплексонометрически с индикатором эриохром черным Т (хромоген черный ЕТ-00, солохром черный Т, ализарин черный Т), представляющим собой натриевую соль (1-окси-2-нафтилазо)-6"-нитро-2"-нафтол-4"-сульфокислоты.
При рН 6 эриохром черный Т окрашен в вишто-красный цвет. При более высоком значении рН окраска переходит в синюю и при рН 12 становится желто-оранжевой (рКг = 6,3; рйГ2 = = 11,5).
С магнием и кальцием эриохром черный Т образует комплексные соединения с отношением катиопа к лиганду 1: 1 .
Чувствительность взаимодействия эриохром черного Т с кальцием (1,4-10~б г Са1мл) значительно меньше, чем с магнием (8,4-Ю-8 г Mg/лм) .
К раствору, содержащему магний и кальций, прибавляют воду до объема 100 мл, 5 мл аммиачного буферного раствора (рН 10--11) (20 мг NH4C1 растворяют в воде, прибавляют 100 мл 25%-ного раствора NH4OH и разбавляют до 1 л водой), 4--5 капель индикатора (0,5 г индикатора растворяют в 20 мл аммиачного буферного раствора и разбавляют до 100 мл этанолом) и титруют 0,01 М раствором комплексона Ш до перехода винно-красной окраски в синюю.
При определении кальция в отсутствие магния или при низких его содержаниях не наблюдается четкого перехода окрасок эриохром черного Т ;
РЬ амальгама/РЬС204-СаСа04/Са2+ вариантах. Если суспензию получают с концентрированными растворами реагента в присутствии спирта, результаты более воспроизводимы. Увеличивает чувствительность определения присутствие аммиака; соли и кислоты понижают ее . Для стабилизации суспензии добавляют защитный коллоид .При анализе биологических объектов (кровь, моча) применяют нефелометрический метод определения кальция с олеатным реактивом .
Определение кальция в сыворотке крови олеатным методом выполняется следующим образом .
К 0,5 мг сыворотки прибавляют 1 мл воды и 0,5 мл 20%-ного раствора трихлоруксусной кислоты. Через 5 мин. осадок центрифугируют. 1,3 мл центрифугата помещают в колориметрическую кювету, прибавляют 0,2 мл конц. NH4OH и 1 мл олеатного реагента. Через 15 мин. определяют кальций турбидиметрически при 420 нм.
Описаны нефелометрические и турбидиметрические методы определения кальция со стеариновой кислотой , сульфорицинатом или сульфоорцинолеатом натрия . Последний реагент позволяет определять кальций в присутствии магния (на фоне ионов аммония магний не осаждается сульфоорцинолеатом).
Кальций можно определять, нефелометрируя суспензию сульфата кальция. Предложен следующий метод определения кальция в почвах .
2,5 г воздушно-сухой почвы встряхивают 30 сек. при 25--35° С с 25 мл раствора экстрагепта (0,05iV HaS04, содержащая 0,35 г бората/л, рН 1,6) и фильтруют. Раствор нейтрализуют по бриллиантовому желтому 10%-ным раствором NaOH и подкисляют 5 N СН3СООН. К 2 мл этого раствора в колориметрической пробирке прибавляют 2 мл этилового спирта, высаливающего CaS04, встряхивают и через 5 мин. сравнивают со стандартами, приготовленными из сульфата кальция аналогичной обработкой.
Описано нефелометрическое определение кальция с н а ф т и л-гидроксаматом натрия и хлораниловой кислотой .
2.7 Флуориметрические методы
Количественное флуориметрическое определение кальция применяется сравнительно редко. Чаще всего используют метод, основанный на взаимодействии ионов кальция с флуорексо-ном (кальцеином) с образованием флуоресцирующего комплекса. Флуорексон в щелочном растворе не флуоресцирует. Максимум флуоресценции наблюдается при 517 нм . Для установления соответствующего значения рН используют 0,liV раствор КОН. В присутствии едкого натра или аммиака наблюдается довольно значительная флуоресценция холостого опыта. Мешают А1, Ва, Си, Sr, Zn, Mn, Fe, которые дают такую же желто-зеленую флуоресценцию, как и кальций. AI, Fe и Мп можно замаскировать триэтаноламином; Са, Со, Си и Zn -- цианидами.Чувствительность реакции 0,08 мкг Са/1 мл раствора .Флуоресцентное определение кальция с флуорексоном используют при анализе биологических объектов .
Описано флуоресцентное определение кальция с флуорексоном в полиэтилене низкого давления .
8-0 ксихинолилгидразон 8-хинальдинового альдегида отличается высокой чувствительностью и избирательностью при определении кальция. Возникающая зеленая флуоресценция развивается 10--15 мин. Реакцию проводят в 0,1 М растворе КОН. Чувствительность определения с учетом критерия Зо" составляет 0,02 мкг Са/5 мл раствора. Не мешают определению щелочные металлы, 10-кратные количества стронция, 100-кратные количества Mg, Ва, равные количества РЬ, Fe, Mn, Си, In, Cd, Zn; 10-кратные количества Со, Fe, Та, 100-кратные количества Be, Сг; 1000-кратные W, Bi, Pt и Ni гасят флуоресценцию. В присутствии 200 мкг Mg/5 мл 0,lN раствора КОН появляется красная люминесценция, которая мешает определению кальция в окиси магния . Для удержания магния в растворе добавляют хлорид аммония.
8-Оксихинолилгидразон 8-хинальдинового альдегида применен при определении кальция, в метилтрихлорсилане (5* 10~8%) , в хлориде цезия , в воде и этиловом спирте (10~"%) .
Определение кальция в воде и этиловом спирте выполняют следующим образом.
В двух кварцевых чашках выпаривают по 100 мл воды (128 мл спирта), предварительно добавив в одну из них 0,15 мкг Са. Остаток из каждой чашки смывают 5 мл 0,1 N раствора КОН (2--3 порции)[и переносят в пробирки. Одновременно в третью пробирку наливают 5 мл 0,1 N раствора КОН (контрольный опыт). Во все три пробирки приливают по 0,2 мл 5-Ю-4 М раствора реагента и через 10--15 мин. Измеряют интенсивность флуоресценции на флуориметре ФО-1 с низковольтной лампой накаливания мощностью 20 вт и фотоумножителем ФЭУ-38 с использованием светофильтров; первичных СЗС-21 (3) + СС-5 (а), вторичных ИСС-4 (3) + ОС-11 (3).
2. Экспериментальная часть
Качественный анализ.
Реакции ионов кальция
1. Оксалат аммония образует с ионами кальция кристаллический осадок СаС2О4 · Н2О: Осадок растворим в сильных кислотах, но нерастворим в уксусной кислоте: Предел обнаружения кальция -- 20 мкг. Мешают ионы Ва2+ и Sr2+, дающие с (NH4)2C2O4 аналогичные осадки. Отличительной особенностью осадков ВаС2О4 и SrC2O4 является их растворимость в уксусной кислоте:
2ВаC2O4 + 2СН3COOН = Ва(НC2O4)2 + Ва(СН3COO)2. (22)
Выполнение реакции.
К 2--3 каплям раствора, содержащего ионы кальция, добавляют 2--3 капли раствора реагента. Выпадает белый кристаллический осадок.
Определение кальция методом стандартных добавок.
Экспериментальная часть.
Приборы и реактивы: Пламенный фотометр ФПЛ, ПАЖ, ПФМ и др. Компрессор. Источник возбуждения: пламя светильный газ-воздух. Раствор соли кальция с концентрацией кальция 100 мкг/мл.
Навеску СаСО3 (хч) 0,0250 г (F= MCaCO3/ACa = 2,500) растворяют в стакане в небольшом объеме 2М НСl, переносят раствор в мерную колбу вместимостью 100 мл, доводят до метки дистиллированной водой и тщательно перемешивают.
Выполнение работы.
Пробу анализируемой воды разбавляют дистиллированной водой так, чтобы она содержала примерно 1000 мкг кальция в 10 мл. В три мерные колбы вместимостью 100 мл переносят по 10 мл разбавленной анализируемой воды и добавляют во вторую и третью колбы соответственно 10 и 20 мл раствора соли кальция. Доводят объемы растворов в колбах до меток дистиллированной водой и тщательно перемешивают. Фотометрируют полученные растворы, как указано выше, и записывают результаты в виде таблицы: Номер раствора Объем разбавленной анализируемой воды, мл Объем раствора добавки, мл Концентрация добавки в пробе, мкг/мл Отсчет, мкА 1 10,00 - - 2 10,00 10,00 10,00 3 10,00 20,00 10,00 Определяют неизвестную концентрацию Сх графическим или расчетным методом и находят концентрацию кальция С (в мкг/мл) в питьевой воде по формуле: где VM -- вместимость мерной колбы; VP -- объем аликвотной части анализируемой воды (вода после разбавления); n -- степень разбавления питьевой воды. Если график зависимости аналитического сигнала I от С непрямолинеен, то применяют логарифмический вариант метода.
Размещено на Allbest.ru
...Подобные документы
Исследование физических и химических свойств кальция. Электролитическое и термическое получение кальция и его сплавов. Алюминотермический способ восстановления кальция. Влияние температуры на изменение равновесной упругости паров кальция в системах.
курсовая работа , добавлен 23.10.2013
Химические свойства кальция. Применение чистого карбоната кальция в оптике, известняка в металлургии - в качестве флюсов. Гипс как кристаллогидрат сульфата кальция. Кальциевая соль ортофосфорной кислоты как основной компонент фосфоритов и апатитов.
реферат , добавлен 23.01.2010
Хлорид кальция: физико-химические свойства. применение и сырье. Получение плавленого хлорида кальция из дистиллерной жидкости содового производства. Получение хлорида кальция и гидроксилохлорида из маточного щелока. Безводный кальций из соляной кислоты.
реферат , добавлен 09.08.2008
Соединения магния, кальция и бария как лекарственные средства. Изменения в группе величины радиусов атомов и ионов, потенциал ионизации. Качественные реакции на ионы магния, кальция, стронция. Биологическая роль магния и кальция, значение для организма.
реферат , добавлен 14.04.2015
Кристаллическая структура гидроксилапатита. Описание методов синтеза фосфатов кальция. Рентгеновский фазовый анализ для определения фазового состава образца. Экспериментальное проведение синтеза фосфата кальция методом осаждения из водных растворов.
курсовая работа , добавлен 10.09.2012
Расчет концентрации нитрата кальция в водном растворе для его применения в составе охлаждающей жидкости. Определение зависимости показателя преломления фаз системы вода-нитрат кальция при отрицательной температуре от концентрации методом рефрактометрии.
курсовая работа , добавлен 12.12.2012
Элементы и их соединения в современной неорганической химии. Синтез сульфата кальция, его химические свойства. Проведение качественного анализа на ионы. Расчёт исходных реагентов и определение условий проведения синтеза, выбор приборов и оборудования.
курсовая работа , добавлен 12.12.2009
История и происхождение названия, нахождение в природе, получение кальция, его физические и химические свойства. Применение металлического кальция и его соединений. Биологическая роль и потребность организма в кальции, его содержание в продуктах питания.
реферат , добавлен 27.10.2009
Массовое производство и использование карбоната кальция - неорганического химического соединения, соли угольной кислоты и кальция. Полиморфные модификации карбоната кальция. Фазовая диаграмма кальцита, арагонита и фатерита при разных температурах.
реферат , добавлен 25.11.2015
Элемент главной подгруппы второй группы, четвертого периода периодической системы химических элементов Д. И. Менделеева. История и происхождение названия. Нахождение кальция в природе. Физические и химические свойства. Применение металлического кальция.
ЛАБОРАТОРНАЯ РАБОТА 3. "ОПРЕДЕЛЕНИЕ МАССЫ КАЛЬЦИЯ(II) В РАСТВОРЕ"
Цель работы
Научиться применять метод осаждения для определения массы вещества в растворе.
Целевые задачи
1. Доведение тигля до постоянной массы.
2. Расчет массы кальция(II), необходимой для выполнения анализа с допустимой погрешностью.
3. Получение осаждаемой формы в виде мелкокристаллического осадка кальция оксалата. «Созревание» осадка.
4. Отделение осадка кальция оксалата от маточного раствора фильтрованием.
5. Промывание осадка кальция оксалата.
6. Получение гравиметрической формы кальция сульфата путем прокаливания осадка кальция оксалата, превращения продуктов термического разложения последнего в кальция сульфат и прокаливания полученного осадка до постоянной массы.
7. Расчет массы кальция(II) в растворе.
8. Статистическая обработка результатов параллельных определений массы кальция(II) в растворе.
Задание для самоподготовки
К занятию необходимо знать: см. выше п.п. 1-4, 6 в, 7.
К занятию необходимо уметь: см. выше, п.п. 1, 2 в, 3, 5.
Вопросы для самопроверки: см. выше п.п. 1-4, 5 в, 6 в, 10-13, 15, 16 а,
17-20, 23-34.
Материальное обеспечение
Посуда (в расчете на 1 студента): бюретка вместимостью 25 мл - 1 шт.
Реактивы (квалификации «ч.д.а.» или «х.ч.»)
1. Соли кальция: нитрат или хлорид.
2. Кислота соляная, 6 моль/л (1:1) раствор.
3. Кислота серная, 4 моль/л раствор
3. Аммиак, 10% раствор.
4. Аммония оксалат, 5% раствор.
5. Метиловый оранжевый, 0,1% раствор.
Приборы
1. Бани водяные.
2. Баня песчаная.
Остальное - см. выше лабораторную работу 1.
Учебные таблицы.
Методика определения массы кальция(II) в растворе методом осаждения
1. Сущность методики
Кальций(II) осаждают в виде мелкокристаллического осадка моногидрата кальция оксалата:
при минимальном пересыщении раствора относительно осаждаемой формы.
Согласно методике осадитель аммония оксалат вводят в сильнокислый раствор соли кальция, в котором осадок кальция оксалата не образуется благодаря протеканию конкурирующей реакции протонизации оксалат-иона:

Затем к прозрачному раствору медленно, по каплям добавляют раствор аммиака до рН4 (индикатор - метиловый оранжевый). При этом концентрация оксалат-иона постепенно повышается и происходит осаждение моногидрата кальция оксалата - осаждаемой формы. Для понижения растворимости осадка в кислой среде вводят большой избыток осадителя. В данном случае кальция оксалат образует мелкокристаллический осадок, поэтому после осаждения раствор с осадком оставляют на некоторое время для укрупнения и совершенствования кристаллов осаждаемой формы («созревания» осадка).
Для отделения полученного мелкокристаллического осадка кальция оксалата от маточного раствора используют плотный беззольный бумажный фильтр «синяя лента». Вследствие довольно заметной растворимости кальция оксалата (K S 0 = 2,3 . 10 -9) осадок отмывают от примесей разбавленным раствором аммония оксалата (летучим электролитом, содержащим одноименный с осадком ион). Из одной и той же осаждаемой формы - моногидрат кальция оксалата - можно получить несколько гравиметрических форм (ГФ), в различной степени пригодных для цели анализа (см. «Справочник»).

Первые две гравиметрические формы (ГФ 1 и ГФ 2) трудно получить с точным стехиометрическим составом. Кроме того, эти формы гигроскопичны, поэтому их редко используют на практике.
ГФ 3 (кальция карбонат) обладает некоторыми преимуществами перед ГФ 4 (кальция оксидом): эта форма, в отличие от последней, не гигроскопична и имеет меньший гравиметрический фактор (0,4004 против 0,7147). Однако для ее получения необходимо поддерживать температуру в очень узких пределах (450-550 °C), что на газовой горелке или в муфельной печи трудно осуществить. Именно поэтому обычно при прокаливании получают смесь кальция карбоната и кальция оксида.
В связи с этим более надежным считают получение в качестве ГФ кальция оксида путем прокаливания осадка при температуре выше 900 °C, при которой происходит практически полное превращение кальция карбоната в кальция оксид.
В настоящей работе в качестве ГФ используется кальция сульфат (ГФ 5). Преимуществом использования этой формы перед кальция оксидом является меньший гравиметрический фактор (0,2944) и устойчивость к углекислому газу.
К сожалению, кальция сульфат, так же как и кальция оксид, гигроскопичен, поэтому при измерении массы кальция сульфата требуется принимать определенные меры предосторожности.
Для получения ГФ 5 продукты термического разложения кальция оксалата (смесь кальция карбоната и кальция оксида) обрабатывают серной кислотой:

Затем полученный осадок высушивают и прокаливают до постоянной массы при температуре 900 °C.
2. Предварительные расчеты
Расчет массы кальция, необходимой для выполнения анализа с допустимой погрешностью ±0,2%. Для того, чтобы процентная погрешность определения не превышала ±0,2%, масса гравиметрической формы должна быть не менее 0,1 г. Для кристаллических осадков оптимальная масса ГФ ~0,1-0,5 г. В данном случае она принята за 0,3 г. Тогда масса кальция, подлежащая анализу, должна быть равна примерно
0,1 г:
3. Доведение тигля до постоянной массы
Прокаливание тигля до постоянной массы проводят в муфельной печи при температуре около 900 °C (см. лабораторную работу 1).
4. Получение осаждаемой формы
Полученный от преподавателя анализируемый раствор в стакане вместимостью 300-400 мл, содержащий около 0,1 г кальция(II), разбавляют 150-200 мл дистиллированной воды и приливают к нему по стеклянной палочке 40 мл 5% раствора аммония оксалата. Выделившийся осадок сразу же растворяют в минимальном объеме 6 моль/л раствора соляной кислоты, добавляя его по каплям при перемешивании. Полученный раствор нагревают до 60-70 °C на водяной бане, добавляют 2 капли индикатора метилового оранжевого и медленно, по каплям, из бюретки приливают 10% раствор аммиака до изменения окраски из розовой в желтую (рН4). Осадок настаивают под маточным раствором не менее двух часов.
5. Отделение осадка от раствора фильтрованием
Для отделения осадка от раствора используют плотный беззольный фильтр «синяя лента». (Техника и приемы фильтрования - см. лабораторную работу 1)
6. Промывание осадка
В качестве промывной жидкости используют 1% раствор аммония оксалата. (Техника и приемы промывания осадка - см. лабораторную работу 1) Промывание заканчивают, когда осадок будет полностью отмыт от хлорид-иона.
7. Получение гравиметрической формы
Осадок на фильтре подсушивают в сушильном шкафу, переносят в доведенный до постоянной массы фарфоровый тигель и озоляют (см. лабораторную работу 1). Прокаливание тигля с осадком проводят на газовой горелке до полного выгорания углерода, после чего тигель охлаждают, осторожно смачивают осадок в тигле несколькими каплями воды из пипетки, а затем 2-3 мл 4 моль/л раствора серной кислоты. Для удаления избытка серной кислоты тигель помещают на горячую песчаную баню под тягой и нагревают до прекращения выделения белых паров. Полученный осадок кальция сульфата доводят до постоянной массы прокаливанием на газовой горелке или в муфельной печи при температуре
около 900 °С.
8. Расчет результата анализа
Массу гравиметрической формы определяют, вычитая
определяют, вычитая
из постоянной массы тигля с осадком постоянную массу тигля. Массу кальция рассчитывают по формуле:

где гравиметрический фактор пересчета:

9. Статистическая обработка результатов параллельных определений массы кальция(II) в растворе
Статистическую обработку проводят по массе кальция m(Са), как описано выше.
10. Проверка результата анализа
См. выше.
Контрольные вопросы
1. В чем состоит сущность гравиметрического метода осаждения? Разберите на примере осаждения кальция(II) в виде кальция(II) оксалата.
2. Какие реакции протекают при прокаливании осадка кальция оксалата? Укажите температурный интервал, в котором протекает та или иная реакция.
3. Какие гравиметрические формы можно использовать для определения кальция(II) при получении в качестве осаждаемой формы моногидрата кальция оксалата?
4. Какую гравиметрическую форму вы использовали при определении кальция(II)? Как вы ее получали?
чем ±0,2%?
6. Почему при осаждении кальция по приведенной в работе методике необходимо добавлять большой избыток осадителя?
7. Какую промывную жидкость и почему именно ее используют для промывания осадка кальция оксалата?
К 1,5 мл боратного буферного раствора прибавляют 0,02 мл исследуемой сыворотки и через l,5 мин 0,5 мл 0,05%-ного раствора ГБОА в метаноле и еще через 1,5 мин 1 мл смеси метанола и ацетона. Фотометрируют точно через 5—10 мин после добавления 0,05%-ного раствора ГБОА при длине волны 540—550 нм в кювете с длиной оптического пути 1 см против холостой пробы, в которую вместо исследуемой сыворотки берут воду. Одновременно ставят также калибровочную пробу.
Расчет выполняют по калибровочному графику либо по правилам пропорции.
ГБОА в щелочной среде распадается с образованием анилина и глиоксаля, который затем окисляется в глиоксалевую кислоту, способную образовывать комплексы с кальцием. Даже в растворе абсолютного метанола на протяжении нескольких недель реактив разрушается. Накапливающаяся глиоксалевая кислота в значительно большей степени сказывается на экстинкции опытных, нежели калибровочных, проб. Поэтому измерение оптической плотности должно проводиться в совершенно определенное время, причем при длине волны 540—550 нм показания стабильнее, чем при длине 530 нм, при которой наблюдается максимум пика.