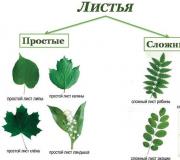
Sinteza novih elemenata. Poreklo hemijskih elemenata
Kada se uranijum bombarduje toplotnim neutronima, iz njega nastaju lakši elementi sa serijskim brojevima 35-65: to je dovelo do nade da će se među krhotinama naći i izotopi elemenata 43 i 61 elementi 43, 61, kao i 85 i 87 1930. godine, mogao se uočiti primjetan napredak. Prije svega, potvrđena je sumnja da su elementi 43 i 61 nestabilne tvari koje su “izumrle”. Što se tiče elemenata 85 i 87, oni su odavno prepoznati kao raspadnute radioaktivne supstance.
Godine 1934, fizičar Joseph Mattauch pronašao je empirijsko pravilo koje omogućava procjenu stabilnosti jezgri izotopa. Prema Mattauchovom pravilu, drugi stabilni izotop ne može postojati ako se naboj njegovog jezgra razlikuje samo za jedan od naboja jezgra poznatog stabilnog izotopa sa istim masenim brojem. Ovaj obrazac nadopunjuje Harkinsovo pravilo, prema kojem su elementi s neparnim serijskim brojem (tj. neparnim brojem protona i elektrona) mnogo rjeđi na Zemlji, jer je stabilnost njihovih jezgara niska.
U odnosu na elemente 43 i 61, Mattauchovo pravilo se može izreći na sljedeći način. Na osnovu njihovog položaja u periodnom sistemu, maseni broj elementa 43 bi trebao biti oko 98, a elementa 61 - oko 147. Međutim, stabilni izotopi su već bili poznati za elemente 42 i 44, kao i za elemente 60 i 62 sa mase od 94 do 102 i, shodno tome, od 142 do 150. Pošto drugi stabilni izotop sa istim masenim brojem ne može postojati, elementi 43 i 61 moraju imati samo nestabilne predstavnike. Nema sumnje da su elementi 43 i 61 nekada bili prisutni na Zemlji u dovoljnim količinama. Kada je nastao naš solarni sistem, svi elementi su nastali kombinacijom protona i neutrona. Međutim, tokom postojanja Zemlje - 4,6 milijardi godina - njihovi nestabilni predstavnici postepeno su potpuno nestali. Izuzetak su samo oni radioaktivni elementi koji bi se mogli stalno nadopunjavati unutar prirodnog radioaktivnog niza, jer njihove matične supstance - uranijum ili torijum - i dalje postoje na Zemlji, zahvaljujući njihovom poluraspadu od milijardi godina. Elementi 43 i 61 ne pripadaju ovim prirodnim radioaktivnim serijama. Samo ako bi dugovječni izotop ovih elemenata bio dostupan, moglo bi se nadati da će se otkriti njegovi radiohemijski tragovi.
Dok su neki naučnici još tragali za lažnim transuranijumima, drugi istraživači su uspeli da pronađu željene elemente 43 i 87. Evo priče o njihovom otkriću... Emilio Segre je 1936. godine nakon braka napustio Fermija i njegove kolege i otišao u Palermo. nekadašnji glavni grad Sicilije. Na tamošnjem univerzitetu mu je ponuđena katedra za fiziku. U Palermu, na njegovu veliku žalost, Segre nije mogao da nastavi istraživanje započeto sa Fermijem. Univerzitet nije imao nikakvu opremu za radioaktivna istraživanja. Nakon što je brzo doneo odluku, italijanski naučnik je otišao u Ameriku da se upozna sa Kalifornijskim univerzitetom u Berkliju, koji je bio poznat po najboljoj opremi. Tada se tu nalazio jedini ciklotron na svijetu. "Izvori radioaktivnosti koje sam vidio bili su zaista nevjerovatni za osobu koja je ranije radila samo sa Ra-Be izvorima", prisjetio se fizičar.
Segrè je bio posebno zainteresiran za ciklotronsku otklonsku ploču. Morao je usmjeriti tok ubrzanih čestica u traženom smjeru. Zbog sudara sa česticama visoke energije - deuteroni su ubrzani - ova ploča je postala vrlo vruća. Stoga je morao biti izrađen od vatrostalnog metala - molibdena. Gost iz Italije skrenuo je pažnju na ovaj metalni molibden, bombardovan deuteronima. Segre je sugerirao da bi izotopi još uvijek nepoznatog elementa 43 mogli nastati od molibdena, elementa 42, kao rezultat bombardiranja deuteronima. Možda, prema jednačini:
Mo + D = X + n
Prirodni molibden je mješavina šest stabilnih izotopa. Segre je predložio: šta ako se jedan od šest mogućih radioaktivnih izotopa elementa 43, u koje bi se molibden teoretski mogao pretvoriti - barem jedan - pokazao dovoljno dugovječnim da izdrži pomorsku plovidbu do Sicilije. Jer, italijanski fizičar je nameravao da traži element 43 samo na institutu u svojoj domovini.
Istraživač je krenuo nazad, držeći u džepu komad molibdenske ploče sa Berklijevog ciklotrona. Krajem januara 1937. započeo je istraživanje uz podršku mineraloga i analitičkog hemičara Perriera. Obojica su, zaista, pronašli radioaktivne atome čija se hemijska svojstva mogu smjestiti između mangana i renija. Količine ekamangana koje su ponovo umjetno oživljene na Zemlji zahvaljujući istraživačkom geniju čovjeka bile su nezamislivo male: od 10-10 do 10-12 g 43. elementa!
Kada su u julu 1937. Segret i Perrier izvijestili o sintezi prvog vještačkog elementa, koji je odavno nestao na Zemlji, bio je to dan koji je otišao u istoriju. Za element 43 kasnije je pronađen vrlo precizan naziv: tehnecij, izveden od grčkog technetos - umjetno. Hoće li ga ikada biti moguće nabaviti u značajnim količinama i držati ga u rukama? Ubrzo je bilo moguće dati pozitivan odgovor na ovo pitanje kada je otkriveno da fisijom uranijuma nastaju izotopi 43 s relativno visokim prinosom. Posebnu pažnju privukao je izotop masenog broja 101 i poluraspada od 14 minuta. Pretpostavljalo se da je Fermijeva supstanca sa poluživotom od 13 minuta, imaginarni element 93, trebala biti izotop elementa 43.
Prirodne radioaktivne serije imaju definitivan oblik - niko drugi se u to nije usudio sumnjati, posebno nakon masovne spektrografske identifikacije uranijuma-235 od strane Dempstera. Međutim, postojala je slaba tačka u seriji uranijum-aktinijum. Prošlo je više od dvadeset godina od kada je uočena „netačnost“ u ovoj seriji, koja je bila gotovo predana zaboravu. Davne 1913/1914. godine engleski hemičar Cranston i austrijski istraživači radioaktivnosti Mayer, Hess i Paneth naišli su na ovu neslaganje dok su proučavali aktinijum. Poznato je da se aktinijum kao beta emiter transformiše u radioaktinijum, odnosno u izotop torijuma. Kada su naučnici proučavali proces transformacije, uvek su primetili slabo alfa zračenje. Ovu zaostalu aktivnost (otprilike 1%) otkrio je i Otto Hahn u eksperimentima proizvodnje čistog aktinijuma. "Nisam se mogao natjerati da pridajem značaj ovoj maloj količini", rekao je Khan kasnije. Vjerovao je da je to najvjerovatnije nečistoća.
Prošlo je mnogo godina. Francuska naučnica Marguerite Perey, službenica čuvenog Instituta za radijum u Parizu, ponovo je krenula ovim tragom, vrlo pažljivo pročistila frakcije aktinijuma i u septembru 1939. godine bila u stanju da prijavi uspešnu izolaciju novog radioaktivnog izotopa. Bio je to element 87 koji je dugo nedostajao, taj nusprodukt koji emituje alfa i koji daje preostali jedan posto aktivnosti aktinija. Madame Perey je pronašla granu u već završenoj seriji, jer se izotop elementa 87 pretvara u aktinijum X na isti način kao i dobro poznati radioaktinijum. Na Pereyjev prijedlog, element 87 je nazvan francium u čast njene domovine.
Istina, hemičari do danas nisu postigli veliki uspjeh u proučavanju elementa 87. Uostalom, svi francuski izotopi su kratkog vijeka i raspadaju se u roku od milisekundi, sekundi ili minuta. Iz tog razloga, element je ostao "nezanimljiv" za mnoge hemijske studije i praktičnu upotrebu. Po potrebi se dobiva umjetno. Naravno, francijum se može „dobiti“ i iz prirodnih izvora, ali ovo je sumnjiv poduhvat: 1 g prirodnog uranijuma sadrži samo 10[-18] g francijuma!
Kada je otkriven periodni sistem, nedostajala su 23 elementa, sada nedostaju samo dva: 61 i 85. Kako je tekao lov na elemente? U ljeto 1938. Emilio Segra ponovo odlazi u Berkeley. Namjeravao je proučavati kratkovječne izotope elementa 43. Naravno, takva istraživanja su morala biti provedena na licu mjesta. Izotopi s kratkim poluraspadom ne bi "preživjeli" put do Italije. Čim je stigao na Berkli, Segre je saznao da mu je povratak u fašističku Italiju postao nemoguć zbog rasnog terora. Segrè je ostao u Berkeleyu i tamo nastavio svoj rad.
Na Berkeleyju, sa snažnijim ciklotronom, bilo je moguće ubrzati alfa čestice do visokih energija. Nakon prevazilaženja takozvanog Kulonovog praga interakcije, ove alfa čestice su bile u stanju da prodru čak i u jezgra teških atoma. Sada je Segre uvideo priliku da transformiše bizmut, element 83, u nepoznati element 85. Zajedno sa Amerikancima Corsonom i Mackenziejem, bombardovao je jezgra bizmuta alfa česticama sa energijom od 29 MeV da bi izvršio sledeći proces:
Bi + He = X + 2n
Reakcija se obistinila. Kada su istraživači završili svoj prvi zajednički rad, 1. marta 1940., samo su oprezno izrazili ideju “o mogućoj proizvodnji radioaktivnog izotopa elementa 85”. Ubrzo nakon toga, već su bili sigurni da je element 85 umjetno proizveden prije nego što je pronađen u prirodi. Ovo drugo je imala tu sreću da su to tek nekoliko godina kasnije uradile Engleskinja Leigh-Smith i švajcarski Minder sa Instituta u Bernu. Oni su uspjeli pokazati da se element 85 formira u radioaktivnom nizu torija kao rezultat sporednog procesa. Za otvoreni element odabrali su ime Anglo-Helvetius, što je kritikovano kao verbalna besmislica. Austrijska istraživačica Karlik i njen saradnik Bernert ubrzo su pronašli element 85 u drugim serijama prirodne radioaktivnosti, takođe kao nusproizvod. Međutim, pravo na davanje imena ovom elementu, koji se nalazi samo u tragovima, ostalo je Segre i njegovim saradnicima: sada se zove astatin, što na grčkom znači nestabilan. Uostalom, najstabilniji izotop ovog elementa ima poluživot od samo 8,3 sata.
U to vrijeme, profesor Segre je također pokušavao sintetizirati element 61. U međuvremenu je postalo jasno da su oba susjeda ovog elementa u periodnom sistemu, neodimijum i samarijum, bili slabo radioaktivni. U početku je to izgledalo iznenađujuće, jer se u to vrijeme vjerovalo da je radioaktivnost svojstvena najtežim elementima. Neodimijum, element 60, emitovao je beta zrake i stoga je morao biti pretvoren u element 61. Činjenica da ovaj nepoznati hemijski element još nije mogao biti izolovan verovatno je posledica njegovog brzog radioaktivnog raspada. sta da radim? Ovdje je rješenje opet bilo umjetno dobiti željeni element. Budući da se element 61 nije mogao naći u prirodi, fizičari su pokušali da ga sintetiziraju.
Godine 1941/42, naučnici Lowe, Poole, Quill i Kurbatov sa Državnog univerziteta Ohajo bombardirali su element rijetke zemlje neodimijum deuteronima ubrzanim u ciklotronu. Otkrili su radioaktivne izotope novog elementa, koji su nazvali ciklonijum. Međutim, to je ostao samo trag na filmu.
Koji su uspjesi Emilija Segrea? On je ozračio prazeodim, element 59, alfa zracima, međutim, ispostavilo se da je obrada izotopa elementa 61 koje je sigurno sintetizirala bila preteška. Njihova izolacija od drugih rijetkih zemljanih elemenata nije uspjela.
Jedna neuvjerljiva studija objavljena je iz Finske. Davne 1935. godine, kemičar Eremetse počeo je analizirati koncentrate mješavine oksida samarija i neodimijuma za prirodni sadržaj 61. elementa. U tu svrhu prerađeno je nekoliko tona apatita.
Prva faza borbe za 61. element imala je neriješeno rezultat. Bilo je nemoguće čak ni prihvatiti predloženi naziv "ciklonijum".
"MISLI NA UVO"
NAUČNI ROMAN ZASNOVAN NA NAUČNOJ TEORIJI
UNIVERZUM, NEUTRONSKA FIZIKA I NEUTRONSKA KEMIJA
Valerij Fedorovič Andrus
"Naš zadatak je da razvijemo sredstva za dobijanje energije iz rezervi koje su večne i neiscrpne, da razvijemo metode koje ne koriste potrošnju i potrošnju bilo kakvih „materijalnih“ medija. Sada smo potpuno sigurni da implementacija ove ideje nije daleko. : mogućnosti razvoja ovog koncepta leže upravo u korištenju čiste energije okolnog prostora za rad motora bilo gdje na planeti..."
(Tesla, 1897.)
Ostavite komentar
| Za početak preuzmite tabelu transformacija hemijskih elemenata |
| I |
| Upoznajte se sa osnovnim konceptima neutronske fizike |
NUKLEARNA KEMIJA
SINTEZA ELEMENTA SA POZICIJE NEUTRONSKE FIZIKE
Razgovarali smo o umjetnoj sintezi elemenata i napomenuli da to nisu elementi, već molekuli, pa čak i legure. Na prvi pogled može izgledati da je ovo hipoteza, a situacija je nekako drugačija. Da bismo stavili završno "i" u ove rasprave, prijeđimo na nuklearnu hemiju.
“...Predmet nuklearne hemije su reakcije u kojima dolazi do transformacije elemenata, tj. promjena u jezgri njihovih atoma.
Spontani raspad radioaktivnih atoma, o kojem je gore raspravljano (na njega ćemo se vratiti), nuklearna je reakcija u kojoj je jedno jezgro početna točka. Poznate su i druge reakcije u kojima proton p, deuteron (jezgro atoma deuterijuma 1 2 H) d, alfa čestica α, neutron n ili foton γ (obično gama zraci) reagiraju s jezgrom. Bilo je moguće izazvati atomske transformacije pod uticajem brzih elektrona. Umjesto α čestica (4 He jezgra), ponekad se koriste jezgra lakšeg izotopa helijuma 3 He. U posljednje vrijeme ubrzana jezgra težih elemenata, uključujući neon, sve se više koriste za bombardiranje atomskih jezgara.
Prva nuklearna reakcija izvedena u laboratoriji bila je reakcija (Rutherford, 1919).
U ovoj reakciji, jezgro dušika reagira s jezgrom helija, koje ima značajnu kinetičku energiju. Kao rezultat sudara nastaju dva nova jezgra: Kiseonik 17 O i Vodonik 1 H. Jezgro 17 O je stabilno, pa ova reakcija ne dovodi do pojave veštačke radioaktivnosti. U većini nuklearnih reakcija nastaju nestabilni izotopi, koji se potom nizom radioaktivnih transformacija pretvaraju u stabilne izotope...”
Radi praktičnosti i kontrasta, materijal ćemo podijeliti na male dijelove s objašnjenjima.
Nemamo jezgra, ali imamo šestokrakog ježa dušika (14 N), kojeg bombardira jež helijuma (4 He) koji se sastoji od atoma vodika i šest petorki neutrona duž "ravnina" kocka.
S obzirom na konačni rezultat reakcije, možemo sa sigurnošću reći sljedeće:
Azotni jež sa šest iglica zakačio je jednu pentadu sa relativnom masom od 0,5 na svaku iglu, što je rezultiralo ježom sa relativnom masom od 17 - Kiseonik. Znamo da je svaki novi sloj petica novi element.
Može li Azotov jež dobiti svih šest A kao rezultat uništenja jednog helijevog ježa? Naravno da nije mogao. Da bi se dobio jedan kisikov jež, bilo je potrebno uništiti mnogo helijevih ježeva, stvarajući neutronski tok sličan gravitacionom, sa istim obrascem rasta ježa. Ovaj tok se možda ne poklapa sa gravitacionim tokom. Kao rezultat uništenja helijuma, neke kocke vodika ostale su netaknute. Višak neutrona je ili slobodni toplotni nosač ili zračenje. Rezultat reakcije je željena jednačina, koja ne odgovara stvarnosti, jer se višak neutrona fluksa ne uzima u obzir. Nadam se da se sjećate da je prema NF-u neutron 9 puta manje mase od onog s kojim se poredi u reakcijama. Hajde da nastavimo.
“...Prema Remyju, nuklearne reakcije se mogu klasificirati po analogiji s običnim kemijskim reakcijama.
U većini umjetnih nuklearnih transformacija javljaju se takozvane reakcije pomicanja ili supstitucije. na primjer:
![]()
Prilikom pisanja nuklearnih reakcija često se koristi skraćena notacija u kojoj su bombardirane i izbačene čestice odvojene zarezom i stavljene u zagrade, ispred kojih se piše simbol izvornog atoma, a poslije simbola rezultirajućeg atoma. Na primjer, gornja reakcija, koju je prvi izveo Rutherford, može se napisati na sljedeći način: 14 N( b,p) 17 O.
U ovom unosu dat ćemo više primjera reakcija nuklearne supstitucije koje se javljaju prilikom bombardiranja ubrzanim česticama aluminijum:
17AL(d,α) 25 Mg, 27 AL(d,p) 28 AL, 27 AL(d,n) 28 Si, 27 AL(p,α) 24 Mg, 27 AL(n,p) 27 Mg.. .”
Ovaj odlomak se bavi reakcijama zamjene. Iz perspektive modela ježa, ovdje nema reakcija zamjene. Kada se jež bombarduje, ili je njegov rast sasvim normalan, kao u prirodi, ili se izgubi neka od petica u iglicama. Savladavši materijal koji je predstavljen u knjizi, možete napisati čitav niz takvih reakcija bez ijednog izostavljanja, a sve su ili već dobijene, ili se mogu dobiti sa 100% vjerovatnoćom.
“...Kao rezultat reakcije adicije, bombardirajuća čestica je zarobljena od strane jezgra, koje zauzvrat ne emituje nijednu drugu česticu, a energija oslobođena u ovom slučaju se oslobađa u obliku γ-zračenja, na primjer:
27\AL(n,γ) 28 AL, 7 Li(p,γ) 8 Be...”
Ovo je isti proces normalnog rasta ježa, zbog čega su neki neutroni uništeni u fragmente γ-zračenjem.
“...Reakcije nuklearne disocijacije (kao i reakcije termičke disocijacije molekula) uzrokovane su kinetičkom energijom sudarajućih čestica. Na primjer: 79 Br(n,2n) 78 Br, 2 N( b,n i b) 1 N, 2 N(g, n) 1 H.
Poslednja reakcija je fotohemijska reakcija, tj. uzrokovano djelovanjem elektromagnetnog zračenja, nuklearnom disocijacijom.
Trenutno su poznate brojne reverzibilne reakcije:
![]()
![]()
Sve reakcije su neutronska interakcija objekta jež - mete, koja je u umjetnom toku bilo neutronskih fragmenata (γ), ili neutrona ili drugih ježeva, sa objektom koji bombardira. Ako je tok gotovih neutrona dovoljno gust, tada će formirati pentade, a jež će rasti.
Ako je neutronski tok raspršen ili se mora dobiti prvo uništavanjem ježa koji bombardira, tada ciljni jež gubi svoje A.
Reakcija disocijacije je srednje stanje protoka između gustog i difuznog.
Već smo pričali o reakcijama veštačke sinteze i fisije, ali, kako kažu Amerikanci, moja reč protiv vaše možda ništa ne znači i onda će svako ostati pri svom mišljenju. Međutim, reakcija fisije koja će sada biti data će u osnovi dokazati da su SF stavovi tačni.
Razmotrimo jednu od reakcija fisije Uranijuma-235, koji se koristi u nuklearnoj energiji, zbog apsorpcije neutrona.
110 54 Xe – β -110 55 Cs – β- 110 56 Ba – β–110 57 Za – β–110 58 Ce stabilno jezgro
235 92 U + 1 0 n → 5 1 0 n
91 36 Kg – β–91 37 Rb – β–91 38 Sr – β–91 39 – β–91 40 Zr stabilno jezgro
Ova reakcija je simbol trijumfa SF-a. Kako je ranije navedeno da se kao rezultat sinteze ne dobijaju elementi, već molekuli, a Uran-235 kao rezultat fisije pokazao je da je to legura Ce i Zg. Čak i teoretski, nemoguće je dobiti od jednog ježa dijeljenjem dva ježa. Zatim slijede uobičajene transformacije u neutronskom fluksu duž NF (β-zračenje).
Ovo je najupečatljiviji primjer koji pokazuje da još nismo naučili razlikovati element i molekul, a posebno legure. Otuda je tabela elemenata, posebno posle tehnecijuma, tabela molekula (legura)!
Kakva je vrsta molekula U=XeKr? Zašto je tako otporna? Da li je moguće dobiti uranijum iz drugih sastavnih elemenata?
Počnimo s posljednjim pitanjem. Ako se Uran posmatra kao zbir relativnih masa, onda se, naravno, može dobiti iz mnogih varijanti pojmova. Međutim, za nas će svi izgledati isto, jer ih ne razlikujemo. Kada se na njemu vrše svakakva istraživanja, on će uvek biti sličan nekom drugom, nama razumljiviji, kako nam se čini. Uranijum ima sivu metalnu boju, što sugeriše da iglice njegovih elemenata imaju mnogo suprotno uvrnutih pentada i različitih ježeva sa različitim zavojima neutrona. Gustina Urana je blizu maksimuma - 19,04 g/cm3 - to je znak "vazdušnih struktura". Toplota fuzije uranijuma je +1130°C, ksenona je 111,5°C, a kriptona 156,6°C. Molekul dva elementa Xe i Kr, u principu, ne može imati tačku topljenja. + 1130°S i još više za stvaranje „vazdušne strukture“.
Pogledajmo sada pobliže konačne proizvode reakcije između Ce i Zr.
Cerijum ima srebrnobijelu boju, t.t. = 804°C, g = 6,77 g/cm3.
Cirkonijum – srebrno-bijele boje, m.p. = 1852°S, g = 6,52 g/cm3
Da bi se dobile karakteristike uranijuma, molekula se mora sastojati od cerija i cirkonija, a spoj igala ne bi trebao stvoriti kubičnu rešetku, već rombičnu. Tada će se pojaviti sivkasta boja, "prozračnost rešetke" i gustina tmelt će se povećati. približiće se prosečnoj vrednosti. Neutronski spin cirkonija će se smanjiti, a cerijum će se povećati. Za ovu reakciju možemo pisati
U = Ce Zr 4 – početni proizvod (legura Ce 20 Zr 80)
Uran se dobija kao rezultat sedimentnih veza sa zglobnim čvorovima u četiri igle samo sa pravilnom rombičnom formacijom.
Hajde da rezimiramo:
Reakcija sinteze je kombinacija dva ili više elemenata u molekulu u kratkotrajnom procesu koji zamjenjuje spori sedimentni proces u prirodi, s njihovim djelomičnim uništenjem.
Reakcija fisije je brzi raskid molekule na dva ili više elemenata s njihovim djelomičnim uništenjem. Broj završnih elemenata jednak je broju početnih elemenata u molekulu.
Kao što vidite, moraćete još da se mučite sa tabelom elemenata.
Vratimo se nuklearnoj reakciji
Ovdje se ugljik dobiva kao rezultat napada α-paketa Bora. Bor se takođe nalazi u kavezu sa tečnim berilijumom i ima tri pentade u iglama. Obojica očigledno nisu na svom mestu. Gledamo tabelu D.I. Mendeljejeva i vidimo gustinu u rasponu od 1,5÷2,5 g/cm 3 za 11 elemenata (Be, B, C, Mg, Si, P, S, Cl, Ar, Ca, Cs).
Cezijum (Cs) je 55. element sa dužinom igle prema relativnoj masi jednakoj 44 pentade sa gustinom g = 1,959 g/cm 3 . Prema neutronskoj logici, trebalo bi da stoji ispred bora i ugljenika i da ima dužinu igle od dve pentade i da bude bestežinski u zemljinoj atmosferi, ali u praksi sva tri elementa to nemaju.
Prema analizi karbida, koja neće biti data, ugljenik se nalazi između cirkonija (Zr) i niobija (Nb). Posljednji (Nb), prema tablici transformacije, nalazi se u posljednjoj ćeliji cirkonija (Zr).
Dužina Carbon igala bi trebala biti oko 30 petica. Samo u ovom slučaju dijamant može primiti kanale probušene užadima Svjetlosti poput laserskog zraka čija je debljina do 30 niti u jednom užetu.
Prva metoda dobijanja malih dijamanata pogodnih za polirane dijamante je sljedeća:
Fini grafitni prah se sipa u posudu sa vodom i ostavi da se mirno slegne.
Nakon što se sav prah slegne na dno, voda se uklanja na najmirniji način.
Kompresovani crijep mora se zagrijati visokofrekventnim strujama (visokofrekventnim strujama) u komprimiranom stanju do maksimalne temperature, najbolje do 3000 o C, i držati.
Postavite vruću pločicu ispod lasera, koji mora proći svoj snop liniju po liniju, slično skeniranju kadra na TV-u.
Spori i nježni proces će proizvesti kristale tanke kao pločice. U isto vrijeme, možete kontrolirati transparentnost ponavljanjem prolaska laserskog snopa.
Da bi se dobili veliki i vrlo veliki dijamanti, cijeli proces završne obrade mora se obaviti još sporije. Ponavljamo prve četiri tehnološke tačke. Oblik grafita mora odgovarati obliku budućeg dijamanta.
Vrući grafit postavljamo u komoru za duboko zamrzavanje u podesivom mehanizmu za tresenje i naglo snižavamo temperaturu u komori na vrijednost blizu –260 o C. Time se postiže udarni tok topline iz središta obratka prema površini, koji nežno će uništiti neke od zglobova. Nakon potpunog hlađenja vršimo lagano protresanje dok radni komad nije potpuno providan. Kao rezultat podrhtavanja, najmanje vibracija će se pojaviti u dijamantskoj strukturi, koja je potpuno međusobno povezana. Grafit koji nije spojen okomito će imati slobodan zamah, što će dovesti do lomljenja igala i otvaranja kanala za užad Svjetlosti.
Od nastanka naše planete prošlo je oko 4,5 milijardi godina. Sada su na Zemlji sačuvani samo oni elementi koji se za to vrijeme nisu raspali, odnosno uspjeli su "preživjeti" do danas - drugim riječima, njihov poluživot je duži od starosti Zemlje. Nazive ovih elemenata možemo vidjeti u periodnom sistemu elemenata (sve do uranijuma).
Svi elementi teži od uranijuma nekada su nastali u procesu nuklearne fuzije, ali nisu preživjeli do danas. Jer su već raskinuli.
Zato su ljudi prisiljeni da ih ponovo reprodukuju.
na primjer: Plutonijum. Njegovo vrijeme poluraspada je samo 25 hiljada godina - vrlo malo u poređenju sa životom Zemlje. Ovaj element je, kažu stručnjaci, sigurno postojao pri rođenju planete, ali se već raspao. Plutonijum se veštački proizvodi u desetinama tona i poznato je da je jedan od najmoćnijih izvora energije.
Šta je proces vještačke sinteze?
Naučnici nisu u stanju da rekreiraju situaciju uslovnog „stvaranja svijeta“ (tj. neophodnog stanja materije na temperaturama od milijardi stepeni Celzijusa) u laboratorijskim uslovima. Nemoguće je „stvoriti“ elemente baš onako kako su to činili tokom formiranja Sunčevog sistema i Zemlje. U procesu umjetne sinteze, stručnjaci koriste sredstva dostupna ovdje na Zemlji, ali stječu opću predstavu o tome kako bi se to moglo dogoditi tada i kako se to može dogoditi sada na udaljenim zvijezdama.
Uopšteno govoreći, eksperiment se odvija na sljedeći način. Neutroni se dodaju u jezgro prirodnog elementa (kalcijum, na primjer) sve dok ih jezgro više ne može prihvatiti. Posljednji izotop, preopterećen neutronima, ne traje dugo, a sljedeći se uopće ne može proizvesti. Ovo je kritična tačka: granica postojanja jezgara preopterećenih neutronima.
Koliko novih elemenata se može kreirati?
Nepoznato. Pitanje granice periodnog sistema je i dalje otvoreno.
Ko je smislio nazive za nove elemente?
Sama procedura za prepoznavanje novog elementa je vrlo složena. Jedan od ključnih zahtjeva je da otkriće mora biti nezavisno unakrsno provjereno i eksperimentalno potvrđeno. To znači da se mora ponoviti.
Na primjer, bilo je potrebno 14 godina za zvanično priznanje 112. elementa, koje je u Njemačkoj stečeno 1996. godine. Ceremonija "krštenja" elementa održana je tek u julu 2010. godine.
Ima ih nekoliko u svijetu najpoznatijih laboratorija, čiji su zaposlenici uspjeli sintetizirati jedan ili čak nekoliko novih elemenata. To su Zajednički institut za nuklearna istraživanja u Dubni (Moskovska oblast), Livermorska nacionalna laboratorija. Lawrence u Kaliforniji (SAD), Nacionalna laboratorija. Lawrence Berkeley (SAD), Evropski centar za proučavanje teških jona. Helmholtz u Darmstadtu (Njemačka) itd.
Nakon što je Međunarodna unija čiste i primijenjene hemije (IUPAC) priznala sintezu novih hemijskih elemenata, pravo da predlažu imena za njih primaju ih zvanično priznati otkrivači.
U pripremi su korišteni materijali iz članaka i intervjua sa akademikom Jurijem Oganesianom, naučnim direktorom Flerovove laboratorije za nuklearne reakcije Zajedničkog instituta za nuklearna istraživanja u Dubni.
Sintetizirani (vještački) hemijski elementi- elementi koji su prvi put identificirani kao proizvod umjetne sinteze. Neki od njih (teški transuranski elementi, svi transaktinoidi) su očigledno odsutni u prirodi; drugi elementi su naknadno otkriveni u količinama u tragovima u zemljinoj kori (tehnecijum, prometijum, astatin, neptunijum, plutonijum, americijum, kurijum, berkelijum, kalifornij), u fotosferama zvezda (tehnecijum i možda prometijum), u školjkama supernova ( kalifornija i, vjerovatno, proizvodi njegovog raspadanja su berkelijum, kurijum, americij i lakši).Posljednji element pronađen u prirodi prije nego što je umjetno sintetiziran bio je francij (1939.). Prvi sintetizovani hemijski element bio je tehnecijum 1937. Od 2012. godine, elementi do ununoktijuma sa atomskim brojem 118 su sintetizovani nuklearnom fuzijom ili fisijom, a učinjeni su pokušaji da se sintetišu sledeći superteški transuranski elementi. Sinteza novih transaktinoida i superaktinoida se nastavlja.
Najpoznatije laboratorije koje su sintetizirale nekoliko novih elemenata i nekoliko desetina ili stotina novih izotopa su Nacionalna laboratorija. Lawrence Berkeley i Livermore National Laboratory u SAD-u, Zajednički institut za nuklearna istraživanja u SSSR/Rusija (Dubna), Evropski Helmholtz centar za istraživanje teških jona u Njemačkoj, Cavendish laboratorij Univerziteta Cambridge u UK, Institut za fizička i hemijska istraživanja u Japanu i drugi noviji Već decenijama međunarodni timovi rade na sintezi elemenata u američkim, nemačkim i ruskim centrima.
- 1 Otvaranje sintetiziranih elemenata po zemljama
- 1.1 SSSR, Rusija
- 1.2 SAD
- 1.3 Njemačka
- 1.4 Osporeni prioriteti i zajednički rezultati
- 1.4.1 SAD i Italija
- 1.4.2 SSSR i SAD
- 1.4.3 Rusija i Njemačka
- 1.4.4 Rusija i Japan
- 2 Napomene
- 3 Linkovi
Otkrivanje sintetizovanih elemenata po zemljama
SSSR, Rusija
Elementi nobelijum (102), flerovijum (114), ununpentij (115), livermorijum (116), ununseptijum (117), ununoktijum (118) sintetizovani su u SSSR-u i Rusiji.
USA
U SAD su elementi prometijum (61), astat (85), neptunijum (93), plutonijum (94), americij (95), kurij (96), berkelijum (97), kalifornij (98), einsteinijum (99) , fermijum (100), mendelevijum (101), siborgijum (106).
Njemačka
Elementi hassium (108), meitnerium (109), darmstadtium (110), reentgenium (111) i copernicium (112) sintetizirani su u Njemačkoj.
Osporeni prioriteti i zajednički rezultati
Za niz elemenata, prioritet je jednako odobren prema odluci zajedničke komisije IUPAC-a i IUPAP-a ili ostaje kontroverzan:
SAD i Italije
Tehnecij (43) - zajednički napor proizveden u akceleratoru u Berkeleyu u Kaliforniji i hemijski identificiran u Palermu na Siciliji.
SSSR i SAD
Lorencijum (103), ruterfordijum (104), dubnij (105).
Rusija i Njemačka
Borius (107).
Rusija i Japan
Ununtriy (113).
Bilješke
- Emsley John. Nature's Building Blocks: An A-Z Guide to the Elements - New York, NY: Oxford University Press, 2011. - ISBN 978-0-19-960563-7.
- Institut u Dubni postao je četvrti u svijetu po broju otkrivenih izotopa
- Izotop rangiranje otkriva vodeće laboratorije inž.
- http://flerovlab.jinr.ru/rus/elements.html
- Privremeni naziv za 115. element; predloženo je ime Langevinia.
- Privremeni naziv za 117. element;
- Privremeni naziv za 118. element; Predloženo je ime Moskovski.
- R. C. Barber et al. Otkriće elemenata transfermija (engleski) // Pure and Applied Chemistry. - 1993. - T. 65. - Br. 8. - P. 1757-1814.
- Nedavno sam više puta morao pisati o situaciji s kršenjem prioriteta sovjetskih naučnika u sintezi superteških
- O prioritetnoj zaštiti
- Hemija: periodni sistem: darmstadtium: istorijski podaci
- http://element114.narod.ru/Projects/ao-iupac.html
- O prioritetnoj zaštiti
- Privremeni naziv za 113. element; Predložena su imena bekerelija, japonijum, rikenijum i nihonijum.
sva akumulirana naučna saznanja bila bi uništena, a samo jedna fraza bi se prenijela na sljedeće generacije ljudi, koja onda izjava,
sastavljen od najmanje riječi, prenio bi najviše informacija? Ja verujem u to
ovo je atomsko-molekularna teorija: sva tijela su sastavljena
sastoje se od atoma i molekula – malih čestica koje
su u stalnom pokretu, privučeni
jedan prema drugom na maloj udaljenosti, ali se odbijaju ako su pritisnuti bliže jedno drugom. Ova jedna fraza sadrži nevjerovatnu količinu
informacije o svijetu, samo trebate primijeniti malo mašte i malo obzira."
Richard Feynman. Godine 1869. D.I. Mendeljejev je objavio periodični zakon i njegovu posljedicu - tabelu elemenata.
Godine 1870. nazvao je sto "prirodnim", i
nakon još godinu dana - "periodično". Izgled prvih verzija stolova bio je daleko od modernog. U to vreme
U to vrijeme bila su poznata samo 63 elementa (sada
118), inertni gasovi, aktinidi,
i, što je najvažnije, nije bilo informacija o strukturi atoma. Tablica se sastojala od 6 vertikalnih
kolone (prethodnici modernih perioda) i sadržavao je 67 elemenata (63 poznata + 4
predviđeno). Tri od predviđenih (ekabor,
ekasilicijum i ekaaluminijum) ubrzo su otkriveni
i prema tome su nazvani: scandium Sc,
germanijum Ge i galijum Ga. Nakon toga, periodični zakon je dobio univerzalno priznanje.
"Kratka" forma tabele, 2000
Objašnjenje periodnog sistema elemenata jedan je od najvažnijih zadataka atomske fizike.
Hajde da prvo formulišemo principe na kojima se ovo objašnjenje zasniva:1). Stanje elektrona u atomu u potpunosti je određeno sa četiri kvantna broja:
glavni kvantni broj
n = 1, 2, 3, …;
orbitalni
kvantni broj
l = 0, 1, …, n-1;
magnetni kvantni broj m = 0, ±1, ±2, …, ±l;
magnetni spin
kvantni broj
ms = +1/2, -1/2. 2) Paulijev princip: U atomu može postojati samo jedan elektron u stanju
karakteriziraju ove vrijednosti
četiri kvantna broja; one. dva elektrona
u istom atomu mora
barem se razlikuju po značenju
jedan kvantni broj.
3) Atom (kao i svaki sistem) je tada stabilan
kada je u najnižem stanju
moguća energija. Kolekcija elektrona koji imaju iste oblike glavnog kvantnog broja
sloj. Slojevi imaju imena:
n
1
2
3
4
5
6
...
Ime
K
L
M
N
O
P
...
Kolekcija elektrona koji imaju isto
n i l, formira ljusku. Nazivi školjki:
l
0
1
2
3
4
5
...
Ime
s
str
d
f
g
h
...Paulijev princip ograničava broj elektrona
na jednoj ili drugoj elektronskoj ljusci. Zaista, elektroni u nepobuđenom atomu
imaju tendenciju da pređu u stanje sa najmanje
energije (u stabilno stanje), što odgovara minimalnim vrijednostima glavne
i orbitalni brojevi. Međutim, mogućnost takve tranzicije ograničena je Paulijevim principom.
Dakle, elektroni u nepobuđenom atomu
nalaze se u uslovima u kojima
energija atoma je najmanja, ali
distribucija po državama zadovoljava
Paulijev princip.
Hajde sada da ustanovimo koliko elektrona može biti na ljusci iu atomu.
Jer broj ms može imati dvije vrijednosti, zatim inatom može imati dva elektrona sa istim brojevima n, l, m.
Za dati l, kvantni broj m može imati
(2 l +1) vrijednosti, dakle, na ljusci može biti 2 (2 l +1) elektrona, tj.
l
0
1
2
3
4
5
6
Ime
s
str
d
f
g
h
i
Max. broj
elektrona
2
6
10
14
18
22
26Za dato n, kvantni broj l može uzeti n vrijednosti: 0, 1, 2, ..., n -1. Stoga se maksimalni broj elektrona u sloju može izraziti kao zbir aritmetičke progresije:
2 2(2(n 1) 1)
2
2(2l 1)
n 2n (17.1)
2
l 0
n 1
n
1
2
3
4
5
6
7
Ime
K
L
M
N
O
P
Q
Max. broj
elektrona
2
8
18
32
50
72
98
Grafičke slike elektronskih s-, p- i d-ljuski
Grafičkislike
elektronski
s-, p- i d školjke
Grafički prikaz ljuske 4f
Šematski prikazi elektronskih ljuski
Vrsta elektronskih školjki
Konfiguracija elektronskih omotača atoma zapisana je pomoću sljedeće notacije. Svaka ljuska je označena odgovarajućim n i slovom koje predstavlja l, a indeks u gornjem desnom uglu označava broj elektrona. na primjer:Vodonik
1s1
Helijum
1s2
litijum
1s22s1
Karbon
1s22s22p2
Kiseonik
1s22s22p4
Argon
1s22s22p63s23p6 Dakle, Paulijev princip daje sljedeću sliku konstrukcije elektronske ljuske atoma. Svaki
novododati elektron je vezan
stanje sa najnižim mogućim kvantnim brojevima. Ovi elektroni se postepeno pune
sloj sa istim glavnim kvantnim brojem
n. Kada je konstrukcija sloja završena, dobija se stabilna struktura (inertni gas). Sljedeći elektron počinje ispunjavati novi
sloj, itd. Ova idealna šema se slijedi do
18. element periodnog sistema (do argona).
Počevši od 19. elementa (kalijum), uočavaju se odstupanja od idealne šeme. Razlog za ova odstupanja je što je idealno kolo
ne uzima u obzir interakciju elektrona između
sebe. Na primjer, 19. elektron kalija trebao bi (prema idealnoj shemi) biti u 3d ljusci. Međutim, hemijski i spektroskopski
podaci ukazuju da je ovaj elektron u ljusci 4s. Detaljna kalkulacija sa
uzimanje u obzir interakcije elektrona pokazuje da 3d stanje zapravo odgovara
više energije od 4s. Iz istog razloga je i 20. elektron kalcijuma
pridružuje se u 4s stanju, a normalno punjenje 3d ljuske počinje u skandijumu. Slično kršenje normalnog poretka uočeno je u rubidiju, cezijumu i francijumu. Još jedno povlačenje
od normalnog redosleda popunjavanja slojeva ima
mjesto u blizini rijetkih zemalja (Z = 57 - 70): punjenje u toku
4f školjke nakon punjenja školjki 5s, 5p i 6s. Još nekoliko primjera konfiguracija elektronskih omotača atoma:
19 Kalijum
1s22s22p63s23p64s1 = 4s1
20 Kalcijum
4s2
36 Krypton
4s23d102p6
37 Rubidijum
4s23d102p65s1 = 5s1
43 Tehnecij
5s14d6
54 Xenon
5s24d105p6
55 Cezijum
6s1
56 Barijum
6s2
57 Lantan
6s25d1
71 Lutecij
6s25d14f14
86 Radon
6s25d104f146p6 Tako je atomska fizika u potpunosti objasnila periodni sistem elemenata. Štaviše
teorija ne samo da je objasnila, već i razjasnila tabelu. Sve do 1922 element Z=72 nije bio poznat. On
je predvidio Mendeljejev i dobio je mesto u grupi retkih zemalja. Međutim, iz teorijskih razloga, grupa rijetkih zemalja
mora sadržavati 14 elemenata (pošto ljuska 4f može sadržavati 14 elektrona), tj. trebalo bi
završavaju sa 71. elementom, i elementom Z=72
trebao bi biti analog cirkonija i titana. Na ovo
je prvi naznačio N. Bohr, a ubrzo je element 72 (hafnij) otkriven u rudama cirkonija i prema njegovim
Ispostavilo se da su hemijska i optička svojstva analog titana i cirkonija, a ne elementi grupe
rijetke zemlje.
Nedostaci kratke forme tabele
Zbog činjenice da je kratki sto ograničen na 8kolone, moramo 4. i naredne periode podijeliti na redove i podgrupe, što je lišeno
hemijsko značenje. Na primjer, u grupi I postoje alkalni metali i oštro različiti
od njih u hemijskim svojstvima zlato, srebro i
bakar. Grupa VII sadrži halogene i vatrostalni metal renijum. Maksimalno kontradiktorno
struktura grupe VIII. Uključuje „trijadu“ gvožđa (Fe, Co, Ni), porodicu metala platine
(Ru, Rh, Pd, Os, Ir, Pt) i inertnih gasova. Postoje također
druge nedostatke.
Dugačak oblik stola
Godine 1989. Međunarodna unija teorijskih iprimijenjena hemija (International Union of Pure and
Primijenjena hemija - IUPAC) ukinuo je kratki obrazac i odobrio novi "dugi" obrazac. Sastoji se od 18 grupa, označenih arapskim brojevima. Ali da bi se održao kontinuitet, paralelno sa brojevima nove grupe, stari brojevi su napisani rimskim brojevima koji označavaju
podgrupe (a, b), kao u skraćenom obliku. U isto vrijeme su ostali elementi (lantanidi i aktinidi).
treća grupa, a za njih su, kao i ranije, dodijeljene posebne linije.
"Dugi" oblik tabele, 2004
"dugo"formu
stolovi,
2004
Periodični sistem elemenata, koji je predložio N. Bohr 1921. godine
Periodičnosistem
elementi,
predloženo
N.Borom
1921. godine
Periodični sistem koji je predložio N. Bohr, a dopunjen novim elementima
Periodičnosistem,
predloženo
N. Borom i
dopunjen novim
elementi
Sastav atomskih jezgara
Jezgra se sastoje od protona i neutrona. Električni naboj protona je e = 1,6 10-19 C, električni naboj neutrona je 0. Mase protona i neutrona su skoro iste:mp = 1,6724·10-27 kg = 938,3 MeV,
mn = 1,6748·10-27 kg = 939,6 MeV
mn - mp = 1,3 MeV
Svojstva protona i neutrona u odnosu na nuklearne sile su ista; moderna fizika ih smatra dva stanja jedne čestice: nukleona. Zbir protona i neutrona u jezgru (tj. broj
nukleoni) naziva se maseni broj:
A=Z+N Trenutno poznato (postoji u prirodi)
ili dobijeno umjetno) cca. 3000 jezgara sa različitim Z i A vrijednostima, od kojih je 268 stabilnih
i 17 “dugovječnih” (dugovječni se zovu
radioaktivna jezgra čije je vrijeme poluraspada
više od 5·108 godina, pa stoga postoje u prirodi). Ukupno ima 285 stabilnih i dugovječnih jezgara;
ostala jezgra su radioaktivna, ima ih više od 2700.
Broj protona Z jednak je rednom broju elementa u tabeli D.I. Trenutno
vremena, poznata su jezgra sa Z vrijednostima od 0 do 118.
Broj neutrona N može biti različit; jezgra sa
koji imaju isti broj protona, ali različit broj neutrona nazivaju se izotopi. Većina elemenata ima više stabilnih izotopa, a rekord drži kalaj
(Z=50), koji ima 10 stabilnih izotopa.
Ali neki elementi (njih 24) imaju samo jedan stabilan izotop i elemente sa brojevima Z = 43 (tehnecij), Z = 61 (prometijum) i
Svi elementi počevši od Z = 84 (polonijum) nemaju niti jedan stabilan izotop.
Primjeri izotopa:
Opća oznaka: AXZ, gdje je X simbol hemijskog elementa. Ponekad to pišu ovako: ZA X.
Vodik ima 2 stabilna izotopa (nalaze se u
priroda): 1H1 (laki vodonik, protij) i 2H1 (teški vodonik, deuterijum), kao i radioaktivni
izotop 3H1 (superteški vodonik, tricijum). Drugi primjeri izotopa:
Helijum ima 2 stabilna izotopa (oni se takođe nalaze u
priroda): 4He2 (obični helijum) i 3He2 (laki helijum). Vještački su dobijeni kratkotrajni (djelići sekunde) izotopi 6He2, 8He2, 10He2.
Uranijum ima 2 nestabilna, ali dugovječna izotopa (koji se nalaze u prirodi): 238U92 (99,3%) i 235U92 (0,7%).
Još 12 izotopa sa životnim vijekom od 2,5·105 godina do nekoliko minuta je umjetno dobijeno.
Jezgra sa istim masenim brojevima A (ali različitim Z i N) nazivaju se izobare. na primjer:
Radioaktivni superteški vodonik tricijum 3H1 i
stabilan lagani helijum 3He2.
Radioaktivni ugljen-14 ("radiougljenik") 14C6 i
stabilni azot 14N7.
Veštački hemijski elementi
Do 1937. 4 elementa ostala su nepoznata douranijum: sa brojevima Z = 43, 61, 85, 87. 1937. italijanski fizičari C. Perrier i E. Segre, radeći na ciklotronu u Berkliju (SAD),
zračenje molibdena deuteronima (jezgri deuterijuma)
dobio element broj 43, nazvan tehnecij:
2
H1 Mo42 Tc43 n
98
99
Odrediti hemijska svojstva tehnecijuma
rastvoren u aqua regia, i otkrio da je
ne precipitira sa cirkonijumom, niobijumom i molibdenom,
i istaloženo je manganom i renijumom, koji su, dakle, hemijski homolozi tehnecijuma, a u periodnom sistemu jedan od njih
je iznad tehnecijuma, a drugi ispod.
tehnecij (Tc)
Trenutno je poznato 16 izotopa tehnecijuma samaseni brojevi od 92 do 107. Najdugovječniji od njih: 98Tc43 (T1/2=4,2·106 godina) i 99Tc43 (T1/2=
2,1·105 godina). Tehnecijum je kasnije otkriven u zanemarljivim količinama u rudama uranijuma, gde nastaje fisijom jezgara uranijuma. U slobodnoj formi jeste
srebrno sivi metal, ρ = 11,5 g/cm3, Tmelt = 2172°C.
Koristi se kao izvor beta čestica u raznim
aparatima, kao i u medicini. Također je ustanovljeno
da su soli tehničke kiseline (na primjer, KTcO4) visoko efikasni inhibitori korozije. U količinama dovoljnim za praktičnu upotrebu
upotrebe, tehnecij se dobija iz otpada iz nuklearne industrije.
Francuska
Element 87 je 1939. godine otkrila francuska radiohemičarka Marguerite PereyPerey) u produktima raspada prirodnog radioaktivnog izotopa aktinijuma-227:
227
Ac89
223
Fr87 He2
4
Trenutno su poznata 34 izotopa francija sa
maseni brojevi od 199 do 232. Najdugovječniji od njih: 223Fr87 (T1/2=22 minuta). Podvrgava se alfa i beta raspadu, stvarajući
astat-219 i radijum-223, respektivno. U nuklearnoj reakciji 18O8 + 197Au79 → 210Fr87 + 5n nastaje izotop
210Fr (T =3 minute). On doživljava alfa raspad
87
1/2
ovo proizvodi astat-206.
Francuska
Francijum je prvi element 7. perioda tabeleD.I. Mendeljejev i hemijski najaktivniji alkalni metal. Formula njegove elektronske ljuske je 7s1.
Trenutno se koristi izotop France-223
u radiohemijskim određivanjem aktinijuma-227, jer
njegovo beta zračenje je lakše detektovati nego
aktinijum alfa čestice. Francij i njegove soli nemaju druge praktične primjene zbog
kratkog poluživota. M. Perey je pokušao
primijeniti francijum u medicini. Uspjela je otkriti da se francij akumulira u stanicama raka
tumora, ali zbog brzog propadanja ne uspijeva
imaju terapeutski efekat.
Astatium (At)
Element br. 85 je dobijen 1940. godine (D. Corson,K.R. Mackenzie, E. Segre, Kalifornijski univerzitet u Berkliju) u reakciji:
4He
209Bi → 211At + 2n
+
2
83
85
Trenutno je poznato 37 izotopa astatina
maseni brojevi od 191 do 229. Najdugovječniji od njih: 209At85 (T1/2 = 5,5 sati), 210At85 (T1/2 =
8,3 sata) i 211At85 (T1/2=7,2 sata); oni doživljavaju
alfa se raspada i e-hvata, formirajući tako
bizmuta i polonijuma, respektivno.
Homolog astatina je jod. Astatin je pretposljednji element 6. perioda; zatim plemeniti gas radon. Formula za elektronsku ljusku astatina je 4f145d106s26p5.
Primjena astatina
Izotop astatin-211 se smatra obećavajućim za upotrebu u medicini. Ovo je čist (tj. bez pratećeg gama ili beta zračenja) izvoralfa čestice. Kada se raspadne, formiraju se alfe
-čestice sa energijom 6,8 MeV. Dužina njihovog putovanja je
biološkog tkiva je samo 60 mikrona, stoga, kada se astat lokalizira u tumoru, dolazi do jonizacije u malom volumenu, a okolno
na tkiva ne utiče njegovo radio zračenje. Astatin
smatra se efikasnim tretmanom za štitnu žlezdu, jer. poput joda, može se akumulirati u ovom organu, kao i melanom (jedan od
većina malignih neoplazmi).
prometijum (pm)
Godine 1945. američki hemičari J. Marinsky, L. Glendenin i C. Coryell izolovali su element 61 iz fisionih proizvoda uranijuma koristeći smole za izmjenu jona. R 1950godine, hemijska svojstva ovog elementa su bila
istražena, a komisija IUPAC-a je to dodijelila
Ime elementa je prometijum (u čast mitskog heroja Prometeja).
Trenutno je poznato 14 izotopa prometija sa
maseni brojevi od 140 do 154. Najdugovječniji od njih: 145Pm61 (T1/2=18 godina).
Prometijum je jedan od lantanida i njegova hemijska svojstva se ne razlikuju od njih. Formula njegove elektronske ljuske je 6s24f5.
Primjena prometija
Metalni prometijum ima heksagonalnu kristalnu strukturu, gustina 7,3 g/cm3, tačka topljenja oko 1100°C, tačka ključanja oko 3000°C.Najveći praktični značaj ima beta-aktivni izotop 147Pm61 (T1/2=2,6 godina), koji nastaje u nuklearnim reaktorima. Njegovo raspadanje nije praćeno gama zračenjem, pa se koristi za proizvodnju sigurnih radioizotopskih izvora struje, gdje se koristi u obliku Pm2O3 oksida, ali i kao komponenta svjetlosti.
kompozicije radioluminiscentnih fosfora (luminiscentnih
kompozicije koje svetle pod uticajem beta čestica) sa dugotrajnim dejstvom (nekoliko godina).
Prvi transuranski elementi: neptunijum i plutonijum
Ovi elementi se dobijaju kao rezultat reakcijeradijativno hvatanje neutrona jezgrima uranijuma238
239
na-238:
n
U 92
U 92
239
Np93 e e
(23min)
Np93
239
Pu94 e e
(2,3 dana)
239
239
U 92
To su teški metali gustine od cca. 20 g/cm3 i
tačka topljenja cca. 640oC. Njihova fizička i hemijska svojstva su takođe proučavana
dobro, kao prirodni elementi. Neptunijum i plutonijum su dobili svoja imena
analogije sa imenima planeta Sunčevog sistema: Neptuna i Plutona, koji se nalaze iza
Uranijum. Neptunijum su prvi dobili E. McMillan (E. McMillan) i F. Abelson (Abelson Ph.) u Nacionalnoj laboratoriji. E. Lawrencea u Berkeleyju (SAD) 1940. godine. U istoj laboratoriji, u tom
1940. E. Macmillan i G. Seaborg (Seaborg G.)
dobio plutonijum (Nobelovu nagradu za hemiju
1951). Za proučavanje fizičkog i hemijskog
svojstva ovih elemenata, do 1942. godine, uz cijenu velikog truda, bilo je moguće dobiti cca. 0,5 mg ovih soli
elementi. Trenutno se izotop 239Pu94 proizvodi u količinama koje se mjere u desetinama
tona godišnje. Trenutno je poznato 15 izotopa neptunija,
najdugovječniji izotop među njima je 237Np93
(T1/2 =2,14·106 godina).
Poznato je 20 izotopa plutonijuma, najdugovječnijeg izotopa 244Pu94 (T1/2=8,2·107 godina).
Izotop 239Pu94 ima T1/2 = 24100 godina.
Prema strukturi elektronske ljuske atoma i njihovim hemijskim svojstvima, oba ova elementa pripadaju aktinidima (puni se ljuska 5f
sa punjenim 6s-, 6p- i 7s-ljuskama). U slobodnom obliku to su srebrno-bijeli metali s tačkom topljenja od cca. 640°C, tačka ključanja pribl. 3500oC.
Kao i svi teški metali, ovi elementi su veoma
toksični, kako u slobodnom obliku tako i u obliku hemijskih spojeva. Americium
Nakon što je akumulirana dovoljna količina plutonijuma-239, postalo je moguće dobiti sljedeće transuranijske elemente.
95. element dobijen je 1944. godine takođe u laboratoriji po imenu. E. Lawrence u grupi Berkeley (SAD).
Američki fizičari na raspolaganju. G. Seaborg kao rezultat dvije reakcije hvatanja neutrona jezgrima
plutonijum i beta raspad plutonijuma-241:
n
239
Pu94
240
Pu94
n 240 Pu94 241 Pu94
241
Pu94
241
Am95 e e Nazvan po zemlji otkrića, latinski naziv je Americium (Am). Trenutno poznato
11 izotopa americijuma, najduže živih
među njima je i izotop 243Am95 (T1/2 = 7370 godina).
Po strukturi elektronske ljuske atoma i hemijskim svojstvima pripada aktinidima.
U slobodnom obliku je srebrnasti metal sa tačkom topljenja od cca. 1180°C, tačka ključanja 2070°C,
gustina 13,7 g/cm3.
Koristi se za proizvodnju izvora neutrona (pomiješanih s berilijumom). To je takođe saopšteno
Neki izotopi americijuma imaju nisku kritičnu masu i mogu se koristiti za stvaranje taktičkog nuklearnog oružja ("nuklearne ljuske" i "nuklearni meci"). Curium
U istoj je 1944. godine dobijen i element 96
laboratorije u SAD od strane iste grupe fizičara pod
ruke G. Seaborg kao rezultat reakcije
4
He2
239
Pu94
Cm96n
242
Nazvan po Pierre Curie i Marie Skłodowska-Curie, latinski naziv Curium (Cm). Trenutno
Vremenom je poznato 14 izotopa kurijuma, najdugovječniji izotop 247Cm96 (T1/2 = 1,6 107
godine). Po strukturi atoma i hemijskim svojstvima spada u aktinide. U slobodnoj formi
To je srebrno-bijeli metal s tačkom topljenja od cca. 1345oS, tačka ključanja 3200oS, gustina 13,5
g/cm3. Koristi se za proizvodnju kompakta
aktuelni izvori u astronautici. Berkelium
Nakon što je akumulirao dovoljnu količinu americijuma, 1949. godine u istoj laboratoriji u SAD pod
ruke G. Seaborg je dobio 97. element kao rezultat reakcije
4
241
243
He2
Am95
Bk97 2n
dobio ime po gradu Berkliju (Berkeley), latinskom nazivu Berkelium (Bk). Trenutno
Poznato je 10 izotopa berkelija, najdugovječniji izotop 247Bk97 (T1/2 = 1380 godina). By
atomskom strukturom i hemijskim svojstvima, pripada aktinidima. Tačka topljenja
986°C, tačka ključanja 2585°C, gustina 14,8 g/cm3. Koristi se, na isti način kao i kurijum, za proizvodnju
kompaktni izvori struje u astronautici. Kalifornija
Nakon što se akumulira dovoljna količina kurijuma,
1950. u SAD pod vodstvom. G. Seaborg je primljen
98. element koji je rezultat reakcije
4
He2 242Cm96 245Cf98n
Latinski naziv Californium (Cf). Trenutno je poznato 15 izotopa kalifornija, najdugovječniji izotop 251Cf98 (T1/2 = 900 godina). By
atomska struktura pripada aktinidima. Tačka topljenja 900°C, gustina 15,1 g/cm3.
Praktična vrijednost je 252Cf98 (T1/2 = 2,6 g),
koji je moćan izvor neutrona
(3·1012 neutrona po 1 g 252Cf98). Također je moguće
upotreba 251Cf98 za proizvodnju kompaktnih nuklearnih metaka (kritična masa 10g). Einsteinium i Fermium
99. i 100. element otkrili su američki fizičari A. Ghiorso, S. G. Thompson i G. H. Higgins 1952. kada su analizirali
produkti eksplozije hidrogenske bombe. Trenutno
eksplozija proizvodi 1024 neutrona za 10-7 sekundi,
dakle, jezgro urana uspijeva uhvatiti 1517 neutrona odjednom, a zatim, kao rezultat lanca beta raspada, nastaju 99. i 100. element:
U 92 15n
238
U 92...
253
253
Es99
U 92 17n 255U 92 ... 255 Fm100
238
Imena su data u čast A. Einsteina i E. Fermija. Latinski nazivi: Einsteinium (Es) i Fermium (Fm). Kasnije su i ovi elementi dobijeni po tradicionalnoj shemi, zračenjem alfa čestica jezgara berkelija i kalifornija.
Trenutno je poznato 13 izotopa einsteinijuma i 16 izotopa fermija. Najdugovječniji među njima: izotop 254Es99 (T1/2 = 276 dana) i
257Fm
100 (T1/2 = 94 dana).
Što se tiče strukture atoma i hemijskih svojstava, oboje
ovi elementi pripadaju teškim aktinidima
(ljuska 5f je skoro popunjena: einsteinium ima 11
elektrona, fermijum ima 12 elektrona u ljusci 5f sa ispunjenim ljuskama 6s, 6p i 7s).
Mete koje sadrže atome einsteinija i fermija
korišćeni su za dobijanje sledećih transuranijumskih elemenata. Mendelevium
Nakon što je akumuliran dovoljan broj atoma einsteinijuma, 1955. je dobijen 101. u istoj laboratoriji u SAD kao i prethodni transuranski elementi (supervizor G. Seaborg).
element u reakciji:
4
He2
253
Es99
256
Md101n
Ime je dato u čast D.I. Mendeljejeva, latinski
ime Mendelevium (Md).
Po strukturi atoma, mendelevij spada u teške aktinide: 13 elektrona u ljusci 5f
sa punjenim 6s-, 6p- i 7s-ljuskama. Sada
Poznato je 9 izotopa mendelevija, najdugovječniji izotop 258Md101 (T1/2 = 55 dana). Nobelijum, Nobelijum (Ne)
Sinteza elementa 102 prvi put je objavljena 1957
d Međunarodna grupa fizičara koji rade u
Stockholm (Švedska), koji ga je nazvao u
čast A. Nobela. Međutim, ovo otkriće nije naknadno potvrđeno. Godine 1958. grupa G. Seaborga objavila je otkriće 254No102, ali svojstva
Ovaj izotop je određen sa velikom greškom.
Godine 1961. u Rusiji, u Zajedničkom institutu za nuklearna istraživanja (JINR) u gradu Dubna kod Moskve, izgrađen je akcelerator teških jona: ciklotron U-400, na kojem je 1963-1966, pod upravom g.
G.N.Flerov je dobio pouzdane informacije
o ovom elementu.
U-400 Akcelerator teških jona Dubna ciklotron
U-400 102. element je dobijen u 3 reakcije:
15
N7 243 Am95 254 No102 4n
16
O8 242 Pu94 254 No102 4n
22
Ne10
U 92
238
256
No102 4n
Trenutno je poznato 10 izotopa nobelijuma,
najdugovječniji izotop među njima je 259No102
(T1/2 = 58 minuta).
Nobelijum je poslednji element grupe aktinida: ima potpuno ispunjenu ljusku 5f
(14 elektrona), a 6s-, 6p- i 7s ljuske su također popunjene. Lorencijum (Lr)
O sintezi jezgara elementa 103 prvi put je izvijestio A. Ghiorso (Berkeley Laboratory) 1961. godine. Ime je dato u čast američkom fizičaru Ernestu
Lawrence, tvorac ciklotrona (Nobelova nagrada
nagrada 1939). 1965-1967 G.N. Flerov u laboratoriji Dubna JINR dobio je 103. element u reakciji 18
243
256
O8
Am95
Lr103 5n
i istraživali svojstva ovog elementa. Sada je poznato 9 izotopa Lawrencijuma, najdugovječniji izotop 260Lr103 (T1/2 = 3 minute).
Prema savremenim ažuriranim podacima, Lawrencium je već d-element, jer sa njim počinje punjenje d-ljuske (1 elektron u 6d-ljusci). Rutherfordium (Rf)
Od 60-ih godina prošlog vijeka, nakon izgradnje U-400, laboratorija Dubna imala je priliku da ravnopravno konkurira laboratoriji Berkeley u sintezi transuranijumskih elemenata. Prvi izotop 104. elementa dobio je G.N. Flerov 1964. godine u reakciji 22
242
260
Ne10
Pu94
RF104 4n
Ubrzo nakon toga, G. Seaborg na Berkeleyu je dobio nekoliko drugih izotopa. Trenutno je poznato 8 izotopa
Rutherfordia, najduže živi među njima
izotop 261Rf104 (T1/2 = 70 sekundi). Prema svojim hemijskim svojstvima, ruterfordijum je d-element, analog hafnijuma i cirkonija (2 elektrona u 6d ljusci). U Rusiji se 104. element zvao Kurchatovy,
ali 1997. IUPAC je odobrio naziv Rutherfordium 105. element Dubnium (Db) je prvi put dobijen 1970. godine
u Dubni u reakciji
22
Ne10 243 Am95 262 Db105 4n
Trenutno su poznata 4 izotopa dubnijuma, najdugovječnijeg izotopa 262Db105 (T1/2=40 sekundi).
106. element Seaborgium (Sg) dobiven je 1974. u reakciji
54
207
259
Cr24
Pb82
Sg106 2n
nazvan po Glennu Seaborgu.
107. element Borijum (Bh) dobijen je 1976. u reakciji
54
Cr24
209
Bi83
261
Bh107 2n
nazvan po Nielsu Boru (N.Bohr). 108. element Hassiy (Hs) sintetiziran je 1984. godine
laboratorija u Darmstadtu (Njemačka) u reakciji:
58
Fe26 208 Pb82 265 Hs108 n
Ime je dobio po njemačkoj pokrajini Hesen (Hasija). Najdugovječniji izotop je 270Hs108 (T1/2 = 22s).
Tamo je sintetizovan 109. element Meitnerium (Mt).
1982. u reakciji: 58
209
266
Fe26
Bi83
Mt109 n
Ime je dobio po austrijskoj naučnici Lise Meitner.
Najdugovječniji izotop je 278Mt109 (T1/2 = 7,6s).
Tamo je sintetizovan 110. element Darmstadtium (Ds).
isto 1995. kao reakcija
62
Ni28
208
Pb82
269
Ds110n
Najdugovječniji izotop je 281Ds110 (T1/2 = 9,6s). 111. element Rentgenijum (Rg) sintetizovan je 1994
u laboratoriju Darmstadt u reakciji:
64
Ni28 209 Bi83 272 Rg111 n
Najdugovječniji izotop je 281Rg111 (T1/2 = 26s).
Tamo je sintetizovan 112. element Kopernicijum (Cn).
1996. u reakciji:
70
Zn30
208
Pb82
Cn112n
277
Najdugovječniji izotop je 285Cn112 (T1/2 = 30s).
113. element nihonijum (Nh) sintetizovan je 2004. godine
Japanski istraživački centar u reakciji
48
Ca20
237
Np93
282
Nh113 3n
Japanci svoju zemlju zovu Nihon (zemlja izlazećeg sunca). Najdugovječniji izotop
286Nh
113 (T1/2 =19,6 s). 114. element flerovijum (Fl) sintetizovan je u Rusiji
na JINR (Dubna) 1999. godine u reakciji:
48
Ca20 244 Pu94 288 Fl114 4n
Ime je dobio u čast Georgija Nikolajeviča Flerova. Najdugovječniji izotop je 289Fl114 (T1/2 = 2,7s).
115. element Moscovium (Mc) sintetiziran je 2004. godine
na istom mestu u reakciji: 48
243
272
Ca20
Am95
Mc115 2n
Najdugovječniji izotop je 289Mc115 (T1/2 =0,16s).
116. element Livermorijum (Lv) sintetizovan je u SAD
2000. godine u istraživačkom centru u Livermoreu
u reakciji
48
Ca20 248Cm96 293 Lv116 3n
Najdugovječniji izotop je 293Lv116 (T1/2 = 53ms). 117. element Tennesine (Ts) sintetiziran je u SAD-u godine
2010 u reakciji: 48
249
294
Ca20
Bk97
Ts117 3n
Ime je dobio po državi Tennessee, gdje se nalazi Nacionalna laboratorija američkog Ministarstva energetike u Oak Ridgeu. Najdugovječniji izotop je 294Ts117 (T1/2 = 51ms).
118. element Oganesson (Og) sintetiziran je u Rusiji
na JINR (Dubna) 2006. godine u reakciji:
86
Kr36 208 Pb82 293Og118 n
Nazvan u čast Jurija Solakoviča Oganesijana. ćao
jedan izotop je poznat, T1/2=0,89ms. Oganesson zaokružuje sedmi period periodnog sistema u smislu njegovih hemijskih svojstava, trebalo bi da bude analog inertnih gasova, otuda i naziv („to“, a ne „ii“).
Ovisnost nuklearne energije vezivanja o parametru deformacije
Isprekidana kriva odgovara Z2/A > 49, tj.Z > 125, A > 320.
Za čvrstu krivinu
Z2/A< 49.
Procjene pomoću kapljičnog modela jezgra pokazuju da je jezgro s brojem
protona Z > 125, trebalo bi "trenutno" (za nuklearne
vrijeme 5·10-22 s) da se podijeli na fragmente, tj. Mendeljejevljev periodni sistem bi trebao završiti oko 125. elementa. Ovisnost T1/2
spontana podjela od parametra
Z2/A. Bijeli krugovi - eksperimentalni podaci; Puna kriva koja siječe sliku izračunava se pomoću modela kapanja
jezgra.
(10-6 godina = 31,5s)